基本介紹
- 中文名:核外電子排布
- 外文名:configuration of extra-nuclear electron
- 排布原理:最低能量原理、泡利不相容原理等
- 排布方法:先確定該原子的核外電子數等
排布原理
 核外電子排布
核外電子排布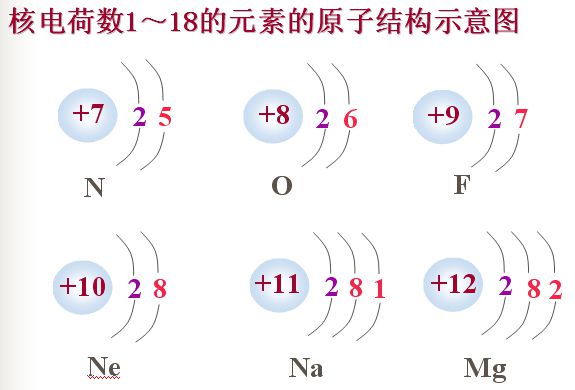
 核外電子排布
核外電子排布處於穩定狀態(基態)的原子,核外電子將儘可能地按能量最低原理排布,另外,由於電子不可能都擠在一起,它們還要遵守最低能量原理,泡利不相容原理和洪特規則,一般而言...
原子核外電子排布規律是指介紹原子核外電子的排布規律,主要有泡利不相容原理、能量最低原理、洪特定則等。...
表示原子核外電子排布的圖式之一。有七個電子層,分別用1、2、3、4、5、6、7等數字表示K、L、M、N、O、P、Q等電子層,用s、p、d、f等符號分別表示各...
核外電子排布 學科 原子物理學 目錄 1 簡介 2 原子軌道的種類 3 排布的規則 4 電子構型對性質的影響 5 參見 電子排布簡介 編輯 電子排序,即電子組態,亦即...
原子核外電子排布是原子核外電子的一種排列規則。...... 原子核外電子排布是原子核外電子的一種排列規則。當原子處在基態時,原子核外電子的排布遵循三個原則:...
電子排布圖是指核外電子的軌道表示式,套用於化學學科。...... 電子排布圖是指核外電子的軌道表示式,套用於化學學科。中文名 電子排布圖 定義 核外電子的軌道表...
氫原子是單電子原子,也就是說,氫原子核外只有一個電子。其餘元素的原子,其電子數都超過一個,例如鈉原子核外有11個電子。在原子核外電子的數目和分布是有一定...
電子在原子核外運動狀態是相當複雜的。一個電子的運動狀態取決於它所處的電子層、電子亞層、軌道的空間伸展方向和自旋狀況。科學實驗還告訴我們,在一個原子裡不...
電子是一種微觀粒子,在原子如此小的空間(直徑約10⁻¹⁰m)內運動,核外電子的運動與巨觀物體運動不同,沒有確定的方向和軌跡,只能用電子云描述它在原子核外...
電子數,就是電子的數量。電子是一種基本粒子,在化學中,電子數一般是指原子或離子的核外電子的數目。...
核外電子在亞層中的排布情況為1S2 2S2 2P6 3S2 3P6 3d2 4S2。金屬活動性在鎂、鋁之間,常溫下並不穩定,因此在自然界中只以化合態存在,常見的鈦的化合物...
原子結構示意圖是表示原子核電荷數和電子層排布的圖示形式。小圈和圈內的數字表示原子核和核內質子數,弧線表示電子層,弧線上的數字表示該層的電子數。...
核外電子排布: 2,8,18,25,9,2核電荷數:64晶體類型:密排六方同位素及放射線: Gd-148[75y] Gd-150[1800000y] Gd-152(放α[1.1E11y]) Gd-154 Gd-...
電子排布: [Xe]5d7 6s2 核外電子排布: 2,8,18,32,15,2 同位素及放射線: Ir-188[1.7d] Ir-189[13.2d] Ir-190[11.8d] Ir-191 Ir-192[73.8d]...
由玻爾的理論發展而來的現代量子物理學認為原子核外電子的可能狀態是不連續的,因此各狀態對應能量也是不連續的。這些能量值就是能級。能級是用來表達在一定能層上(K...
原子序數(atomic number)是指元素在周期表中的序號。數值上等於原子核的核電荷數(即質子數)或中性原子的核外電子數。例如碳的原子序數是6,它的核電荷數(質子數...
