基本介紹
- 中文名:鈹化合物
- 外文名:beryllium compounds
- 顏色:無色
- 溶解性:溶於酸又溶於鹼
- 毒性:高毒性
概述,鈹的化學性質,鈹及鈹化合物的提取,鈹化合物的危害,
概述
鈹化合物一般無色,起氯化物和硫酸鹽易溶於水,氧化物、碳酸鹽和磷酸鹽難溶於水。氧化鈹和氫氧化鈹具有兩性,既溶於酸又溶於鹼。氧化鈹主要用於以知趣鈹鹽和耐火材料。鈹化合物有高毒性。可溶性鈹化合物(如BeCl2、BeF2、BeSO4等)的毒性高於不溶性化合物。高分散度的粉塵、煙霧吸入後,初期使肺硬化,肺泡上皮組織變形,後期可發生惡性腫瘤。從事金屬鈹溶煉、鑄造、加工的人工吸入BeSO4和BeF2達1mg時即發生急性中毒。慢性中毒潛伏期約數周到10年以上,即使停止接觸,仍會發病。
鈹的化學性質
鈹較低的原子半徑和離子半徑決定了它的化學性質。其電離能非常高,與其他原子鍵合時有很強的極化性,所以所有鈹化合物都屬於共價化合物。根據對角線規則,與元素周期表中鄰近的元素相比,鈹的化學性質更接近鋁,因為兩者的電荷半徑之比都很高。鈹的表面會形成氧化層,有效避免進一步被空氣氧化;要加熱至1000°C以上,鈹才會繼續和空氣發生反應。燃燒中的鈹會產生明亮的光芒,並形成氧化鈹和氮化鈹。鈹易溶於如氫氯酸和稀釋硫酸等非氧化酸,但不溶於的硝酸和水。和鋁一樣,鈹在水中會形成氫氧化物保護層,避免進一步反應。鈹也可以溶於鹼溶液中。
鈹原子的電子排布為[He] 2s2。由於有兩個價電子,所以鈹幾乎永遠以+2氧化態形成兩個共價鍵。+1態較罕見,如須在高溫下製備、在低溫下會歧化的的一氯化鈹。根據八隅體規則,原子會儘量達到8價狀態,使電子排布接近稀有氣體元素。鈹在形成兩個共價鍵後會有4個價電子,即八隅體的一半,所以鈹的配位數為4。這一配位數使氟化鈹和氯化鈹等鈹化合物能夠形成聚合物。
[Be(H2O)4]+ H2O[Be(H2O)3(OH)]+ H3O
氧化鈹(BeO)是一種白色耐火材料,晶體結構和硫化鋅相同,熱導率和某些金屬一樣高,屬於兩性化合物。Be(OH)2經酸處理後,可製備各種鈹鹽。已知鈹鹽包括硫化鈹、硒化物和碲化物,它們都具有立方晶系結構。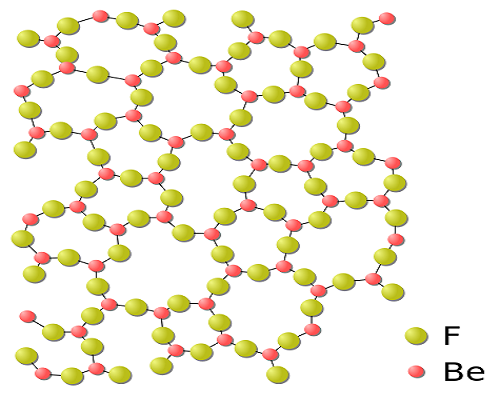 氧化鈹玻璃的不規則結構
氧化鈹玻璃的不規則結構
 氧化鈹玻璃的不規則結構
氧化鈹玻璃的不規則結構氮化鈹(Be3N2)是一種可以輕易水解的高熔點化合物。鈹也可以形成疊氮化鈹(BeN6)。Be3P2的結構與Be3N2相似。鹼式硝酸鈹和鹼式醋酸鈹都具有四面體型結構,每箇中心氧離子與四個鈹原子配位。鈹有幾種已知的硼化物,如Be5B、Be4B、Be2B、BeB2、BeB6和BeB12。碳化鈹(Be2C)是一種磚紅色耐火材料,和水反應後會產生甲烷。鈹沒有已知的矽化物。
鈹及鈹化合物的提取
鈹在高溫下對氧有很強的親和力,在去除表面氧化層後則會對水進行還原反應,因此從化合物中萃取出鈹並不容易。只有美國、中國和哈薩克斯坦有大規模的鈹萃取工業。
鈹一般從綠柱石提取,有用萃取劑燒結或熔化成可溶混合物兩種方法。用燒結法,首先綠柱石在770°C與氟矽酸鈉和鹼混合,形成氟鈹酸鈉和二氧化矽。把氟鈹酸鈉加入氫氧化鈉溶液,使氫氧化鈹沉澱出來。用熔融法,綠柱石須磨碎成粉,並加熱至1650°C。熔融物用水迅速降溫,再在硫酸中重新加熱至250到300°C,主要產生硫酸鈹和硫酸鋁。最後用氨水去除鋁和硫,留下氫氧化鈹。
從氫氧化鈹到鈹金屬也有兩種途徑。用第一種方法,對氫氧化鈹加入水溶氟化氫銨,使四氟鈹酸銨沉澱出來,沉澱物加熱至1000°C後即會形成氟化鈹。氟化鈹在900°C與鎂發生反應,形成鈹細粉,繼續加熱至1300°C之後可得出鈹金屬塊。用另一種方法,對氫氧化鈹加熱產生氧化鈹,再與碳和氯發生反應形成氯化鈹。氯化鈹經電解後即可得出鈹金屬。
鈹化合物的危害
人體內有大約35毫克的鈹,不足以造成傷害。鈹的化學性質和鎂相似,所以會在酶中取代鎂,破壞酶的功能。若在短時間內吸入大量或長期吸入少量的鈹粉塵,都會引致肺部和循環系統肉芽腫病,是為鈹中毒。鈹中毒的症狀可能在五年以後才開始出現,對三分之一病人致死,對其餘則致殘。國際癌症研究機構(IARC)將鈹和鈹化合物列為1類致癌物。美國職業安全與健康管理局(OSHA)為鈹設下了暴露限值為:時間加權平均值每30分鐘0.002mg/m,峰值0.025mg/m。美國國家職業安全衛生研究所(NIOSH)所建議的暴露限值為0.0005mg/m。鈹的立即威脅生命健康值(IDLH)為4mg/m。
歐洲和美國分別在1933年和1943年開始有鈹中毒所造成的化學性肺炎記錄。調查指出,在1949年美國有5%的螢光燈廠工人患有鈹相關的肺病。慢性鈹中毒在很多方面都和結節病相似,鑑別診斷較為困難。一些參與核武器研發的早期工人也因此病逝,如曼哈頓計畫成員赫伯特·安德森。
煤渣可以做研磨劑,用於磨去堅硬表面上的油漆和鐵銹。但煤渣含有鈹,所以鈹會在研磨過程中瀰漫在空氣之中,有吸入攝取的危險。
科學家在早期須辨嘗各種化合物,用味覺判斷鈹的存在,但這種危險性極高的做法已被現代儀器完全淘汰。吸入過多的含鈹飛塵會提高罹患肺癌的可能性,所以鈹和鈹化合物都須要小心處理,特別須避免產生飛塵。雖然鈹化合物自1949年已不再用於螢光燈管中,但在今天仍有一些可能攝取鈹的行業,包括:核工業、航空航天工業、鈹金屬的提煉與鈹合金產業、電子產品產業等等。
國際上已對在空氣中和各種表面上的鈹含量測量法標準達成共識(標準ASTM D7202)。方法先用稀釋氟化氫銨進行溶解,再與硫化羥基苯奎寧結合,最後用螢光檢測法檢測鈹的含量(含量越高則螢光亮度越高)。此方法的靈敏度為工作場所鈹含量建議值的100倍,可在各種表面上探測微量的耐火氧化鈹和矽質鈹(標準ASTM D7458)。

