簡介 Transposon
a segment of DNA that can become integrated at many different sites along a chromosome (especially a segment of bacterial DNA that can be translocated as a whole)
轉座子引起的插入突變 轉座子是一類在細菌的染色體,
質粒 或噬菌體之間自行移動的遺傳成分,是
基因組 中一段特異的具有轉位特性的獨立的DNA序列.
轉座子是存在於染色體DNA上可自主複製和位移的基本單位。最簡單的轉座子不含有任何基因而常被稱為插入序列(IS),它們是
細菌染色體 或質粒DNA的正常組成部分
轉座(因)子是基因組中一段可移動的DNA序列,可以通過切割、重新整合等一系列過程從基因組的一個位置“跳躍”到另一個位置。
複合型的
轉座因子 稱為轉座子(trans—poson,Tn)。這種轉座因子帶有同轉座無關的一些
基因 ,如
抗藥性基因 ,它的兩端就是IS,構成了“左臂”和“右臂”。兩個“臂”可以是正向重複,也可以是
反向重複 。這些兩端的
重複序列 可以作為Tn的一部分隨同Tn轉座,也可以單獨作為IS而轉座。Tn兩端的IS有的是完全相同的,有的則有差別。當兩端的IS完全相同時,每一個IS都可使轉座子轉座;當兩端是不同的IS時,則轉座子的轉座取決於其中的一個IS。Tn有抗生素的
抗性基因 ,Tn很容易從
細菌染色體 轉座到
噬菌體 基因組或是
接合型 的
質粒 。因此,Tn可以很快地傳播到其他細菌細胞,這是自然界中細菌產生抗藥性的重要來源。
兩個相鄰的IS可以使處於它們中間的DNA移動,同時也可製造出新的轉座子。Tn10的兩端是兩個取向相反的IS1O,中間有抗
四環素 的抗性基因(TetR),當Tnl0整合在一個環狀
DNA分子 中間時,就可以產生新的轉座子。當轉座子轉座插入
宿主 DNA時,在插入處產生正向重複序列,其過程是這樣的:先是在靶DNA插入處產生交錯的切口,使靶DNA產生兩個突出的單鏈末端,然後轉座子同單鏈連線,留下的缺口補平,最後就在轉座子插入處生成了宿主DNA的正向重複。
轉座途徑 已知的轉座因子的轉座途徑有兩種:複製轉座和非複製轉座。
複製轉座 複製轉座(replicative transposition) 轉座因子在轉座期間先複製一份拷貝,而後拷貝轉座到新的位置,在原先的位置上仍然保留原來的轉座因子。複製轉座有
轉座酶 (transposase)和解離酶(resolvase)的參與。轉座酶作用於原來的轉座因子的末端,
解離酶 則作用於複製的拷貝。TnA是複製轉座的例子。
非複製 非複製轉座(non-replicative transposition) 轉座因子直接從原來位置上轉座插入新的位置,並留在插入位置上,這種轉座只需
轉座酶 的作用。非複製轉座的結果是在原來的位置上丟失了轉座因子,而在插入位置上增加了轉座因子。這可造成表型的變化。
保留轉座(conservative transposition)也是非複製轉座的一種類型。其特點是
轉座因子 的
切離 和插入類似於入
噬菌體 的整合作用,所用的轉座酶也是屬於入
整合酶 (integrase)家族。出現這種轉座的轉座因子都比較大,而且轉座的往往不只是轉座因子自身,而是連同
宿主 的一部分DNA一起轉座。非複製轉座可以是直接從
供體 分子的轉座子兩端產生
雙鏈 斷裂,使整個轉座子釋放出來,然後在
受體分子 上產生的交錯接口處插入,這是“切割與黏接”(“cut and paste")的方式。另一種方式是在轉座子分子同受體分子之間形成一種交換結構(crossover structure),受體分子上產生交錯的單鏈缺口,與酶切後產生的轉座子單鏈游離末端連線,並在插入位點上產生正向
重複序列 ;最 後,由此生成的交換結構經產生缺口(nick)而使轉座子轉座在受體分子。供體DNA分子上留下雙鏈斷裂,結果 或是供體分子被降解,或是被
DNA修復 系統識別而得到修復。
piggyBac轉座子的老鼠,表達紅色螢光蛋白 在複製轉座過程中,轉座和
切離 是兩個獨立事件。先是由
轉座酶 分別切割轉座子的
供體 和受體DNA分子。轉座子的末端與受體DNA分子連線,並將轉座子複製一份拷貝,由此生成的中間體即共整合體(cointegrat,)有轉座子的兩份拷貝。然後在轉座子的兩份拷貝間發生類似
同源重組 的反應,在
解離酶 的作用下,供體分子同
受體分子 分開,並且各帶一份轉座子拷貝。同時受體分子的靶位點序列也重複了一份拷貝。
酵母
接合型 的相互轉換也是複製轉座所產生。釀酒酵母(Saccharomvcescerf—visiae)的生命周期中有雙倍體細胞和
單倍體 細胞兩種類型。單倍體細胞則有a型和α型兩種接合型(mating type)。單倍體酵母是a型還是α型,由單個
基因座 MAT所決定。MAT有一對
等位基因 MAT。和MATα,在同源接合(homothallic)的
酵母菌 株中,酵母菌十分頻繁地轉換其接合型,即從a轉換成α,然後在下一代又轉換為a。這種轉換和回復的頻率已遠遠高於通常的自發突變,表明這不是通常的突變機制。現在已經知道,在MAT基因座兩側有兩個基因帶有MATα和ATα的拷貝,這就是HMLα和HMRα基因。這兩個基因貯存了兩種
接合型 等位基因,當轉座給MAT
基因座 時就發生了接合型的轉換。因此,MAT基因座是通過轉座而轉換其接合型的。MAT基因座的序列轉換成另一個基因的序列,這種機制稱為
基因轉換 (gene convertion)。
1951年Barbara Mclintock首先在玉米中發現了控制元件,後來命名為
轉座元件 或轉座子(transposon)。轉座子是
基因組 中一段可移動的DNA序列,可以通過切割、重新整合等一系列過程從基因組的一個位置“跳躍”到另一個位置。這一元件不僅可用於分析生物遺傳進化上分子作用引起的一些現象,還為基因工程和分子生物學研究提供了強有力的工具,可以在不了解
基因產物 的生化性質和表達模式的情況下,分離
克隆植物 基因,即轉座子標籤(transposon tagging),又稱為轉座子
示蹤 法。其原理是利用轉座子的插入造成基因突變,以轉座子序列為基礎,從
突變株 的
基因文庫 中篩選出帶有此轉座子的克隆,它必定含有與轉座子序列相鄰的突變基因的部分序列,再利用這部分序列從野生型基因文庫中獲得完整的基因〔1〕。1984年,用轉座子標籤法首先在玉米中分離了bronze基因,該基因編碼了玉米花色素合成途徑的關鍵酶——UDP-葡萄糖類黃3-O-葡萄糖基
轉移酶 〔2〕。此後還利用
轉座子標籤技術 分離了許多植物基因。
分類 轉座子可以分為兩大類:以DNA-DNA方式轉座的轉座子和
反轉錄轉座子 (retrotransposon)。第二類轉座子又稱為返座元(retroposon)〔3〕,是近年新發現的由RNA介導轉座的轉座元件,在結構和複製上與
反轉錄病毒 (retrovirus)類似,只是沒有病毒感染必須的env基因,它通過轉錄合成mRNA,再
逆轉錄 合成新的元件整合到
基因組 中完成轉座,每轉座1次
拷貝數 就會增加1份,因此它是目前所知高等植物中數量最大的一類可活動遺傳成分。目前共發現了3種類型
反轉錄轉座子 :Tyl-copia類,Ty3-gypsy類和LINE(long interspersed nuclear elements)類轉座子,前兩類是具有長
末端重複 的轉座子,LINE類轉座子沒有長末端重複。高等植物中的反轉錄轉座子主要屬於Tyl-copia類,分布十分廣泛,幾乎覆蓋了所有高等植物種類〔4〕。第一類轉座子可以通過
DNA複製 或直接切除兩種方式獲得可移片段,重新插入基因組DNA中。根據轉座的自主性,這類元件又可以分為自主
轉座元件 和非自主轉座元件,前者則需在
自主元件 存在時方可轉座,後者本身能夠編碼
轉座酶 而進行轉座,以玉米的Ac/Ds體系為例,Ac(Activator)屬於自主元件,Ds(Dissociation)則是非自主元件,必需在Ac元件存在下才能轉座〔1〕。
雙轉座子插入引起的外顯子改組 克隆轉座子主要有兩條途徑:其一,利用抗體識別或
cDNA探針 從野生型植株中獲得表達量降低或不穩定
基因座 的序列,再從突變體中分離得到相應的轉座子:其二是根據
序列同源性 ,在
基因組 的不同位置分離同一家族的轉座子成員。目前已經克隆的植物轉座子約156種(來自Genbank的報告),表1列出了常用於轉座子標籤的一些植物轉座子。
表1 常用植物轉座子標籤的轉座子
名 稱 來 源 類 型
Ac(Activator) 玉米 Ⅰ類自主型轉座子
Ds(Dissociation) 玉米 Ⅰ類非自主型轉座子
Mu(Mutator) 玉米 Ⅰ類自主型轉座子
Spm/En 玉米 Ⅰ類自主型轉座子
Tam 金魚草 Ⅰ類自主型轉座子
dTphl 擬南芥 Ⅰ類自主型轉座子
標籤 轉座元件體系
1984年首次用轉座子標籤法克隆了玉米bronze
基因 之後,在其它高等植物中一直沒有發現象Ac/Ds、Spm/En類轉座活性很高的轉座子,因此在很長一段時間內都是利用玉米和金魚草中轉座性質較清楚的內源自主性轉座子。B.Baker等人首先證明了玉米的Ac/Ds
轉座元件 在
轉基因菸草 中有作用,此後又發現Ac/Ds在其他許多物種中如擬南芥、番茄、矮牽牛、亞麻、馬鈴薯、黃豆和水稻中都有活性〔5〕。1993年用Ac元件從矮牽牛中成功地克隆了一個花色素苷合成基因,開創了用外源轉座子在異源
宿主 中分離克隆基因的先河〔6〕。
近年來植物基因工程常用的轉座元件體系分為天然和人工改造兩大類,前者包括
自主元件 單因子體系和反轉錄轉座元件體系,後者主要是人工改造的雙元因子體系。
自主轉座元件單因子體系利用了轉座活性較高的自主轉座子如玉米的Mu轉座子、Ac轉座子和矮牽牛的dTpH1轉座子,已經克隆了擬南芥白化病
基因 (albino)、雄性育
性基因 、番茄的抗病基因Cf-9
等基因 〔7〕。這一轉座體系具有兩大優點:一是在植物中插入
拷貝數 高,如Mu元件每個
基因組 平均拷貝數可達100以上,因此可以在大田自然培養條件下獲得大量突變個體;二是只需篩選相對較少量的植株就能標記所有基因。然而,這一體系也存在一些問題:自主
轉座元件 高頻率的轉座有可能切除
轉座酶 而留下一些序列導致永久突變;自主轉座在
體細胞 內可能造成基因功能自動恢復;
自主元件 切除留下一些片段使轉座元件不能與突變表型
共分離 ,這些都增加了篩選克隆的困難,阻礙了轉座子標籤的推廣〔8〕。
反轉錄轉座元件體系
雖然
反轉錄轉座子 作為一個整體,在整個植物
基因組 中
拷貝數 很多甚至是最多的一類成分,但它包括了許多亞群,有的亞群僅由一個或幾個拷貝組成,這些以單拷貝或
低拷貝 方式存在的成分比較容易識別,同時實驗證明反轉錄轉座子的轉座活動在
組織培養 中能被激活,因此它們是一類很有潛力的轉座子標籤體系。1996年Hirchick等人就利用水稻
反轉錄轉座子 Tos17建立了水稻
基因敲除 體系(gene knock-out system),Tos17可以在組織培養過程中被激活,插入
水稻基因組 中,使基因失效〔3〕。1999年Sato等利用這一體系分離了6個水稻kn1—型
同源異型框 基因,發現了引起水稻植株矮化的突變基因OSH15〔9〕。
最近Lucas等將菸草中的有活性的Ty1-copia類反轉錄轉座子導入擬南芥〔8〕,發現它在後者中進行了轉座,新的拷貝插入到其它
基因 的
可讀框 中。之後又相繼將它導入蕃茄和水稻中,在新的
宿主 中進行了表達,而且宿主的內源反轉錄轉座子不影響新導入轉座子的轉座,說明反轉錄轉座子並不受植物種類差異的影響。雙子葉植物中的
反轉錄轉座子 不僅可在異源雙子葉植物中轉座,也可以在單子葉植物中表達,這為反轉錄轉座子用於轉座子標籤提供了更廣闊的前景。
雙元轉座子體系
雙元轉座子體系由一個非自主
轉座元件 和一個改造過後自身不能轉座的自主轉座元件組成,後者仍編碼
轉座酶 引起前者的轉座,分別構建含兩個元件的植物表達載體,轉化植物培育了分別含有非自主性轉座子和轉座酶的株系,再通過轉基因植株雜交,在F2代就能獲得大量由轉座子引起的突變體。Shimamoto等培育了含Ds轉座元件和含Ac轉座元件轉座酶(AcTPase)
基因 的兩種水稻株系(圖1),通過雜交篩選得到了大量矮化、花期改變的突變體〔10〕。
雙元轉座體系的構建
B:構建編碼轉座酶的
轉座因子 ,Ac元件的轉座酶片段與35S啟動子相連。
為了減少篩選
子代 突變體的工作量,可以在構建的
轉座元件 上插入用於篩選轉化和切除的
標記基因 如抗生素抗性基因、除草劑抗性基因等。Knapp等構建了帶潮黴素
磷酸轉移 酶基因的Ds元件Ds
HPT ,並將該元件插入除草劑抗性基因(ABR)中(圖2),潮黴素抗性基因用於篩選含Ds元件的轉基因植株,BAR基因用於篩選Ds從T-DNA位點切除的轉基因植株〔7〕。
圖2 Ds元件的改造
註:BL T-DNA左邊界區; BR T-DNA左邊界區;
標籤策略 根據利用轉座子標籤的目的不同,可以採取兩種方式的標籤策略:定向標籤和隨機標籤。
定向標籤(directed tagging)
定向標籤是用一個
穩定遺傳 的穩性純合體與一個帶有活躍
轉座元件 的顯性純合體雜交,雜交後代可能產生3種表型:跟顯性親本表型一致,新的表型與隱性親本表型一致,後兩種子代是由於轉座子插入了
顯性等位基因 座。這一策略可以在F1代直接“標籤”感興趣的目的基因〔11〕。
隨機標籤(random tagging)
隨機標籤是將帶有功能性
轉位因子 的顯性
純合 系植株與不帶轉位因子的同種植株雜交,產生的F1子代再自交,在F2代中就可篩選到轉座子隨機插入引起突變表型的
突變株 ,這一策略的目的是為了發現、鑑定帶有多種不同特徵的新突變〔11〕。
分離克隆 Southern-based分離法
這是轉座子標籤分離克隆“標籤”基因的常用方法,它是通過雜交得到純合
突變株 ,構建該類突變株的核
基因文庫 ,以轉座子片作作為探針從該基因文庫中篩選中同源的轉座子,因為轉座子已插入
目的基因 中,於是就篩選得到含突變基因的片段,再將這一片段
亞克隆 標記作為探針,去篩選另一個正常植株的核基因文庫,獲得完整的正常目的基因。為了增加轉座子插入特定基因的機率,需要採用高效轉座子體系,如玉米的Mu元件,但它的標籤群在一個
基因組 內可達100個拷貝,這又給Southern-based分離法分析突變現象,鑑定特定
插入序列 的工作帶來了相當大的工作量,只能通過多代與含低
拷貝數 元件的株系雜交來減少每一植株中插入序列的數量〔12〕。
製造出新的轉座子 PCR-based分離法
反向PCR 分離法:Souer等1995年設計了將反向PCR(Inverse polymerase chain reaction,IPCR)和差別篩選結合的方法,從矮牽牛W138中分離了高效轉座子標籤dTph1標記的
基因 (圖3)〔13〕。W138中含有200個拷貝以上的內源dTph1元件,
自交 後代形成大量不穩定的突變本,包括花色素合成、植物和花發育、育性或葉綠素合成等方面的突變體,用常規方法分離新基因需花大量的時間將
突變株 與含低拷貝數
轉座元件 的株系多次雜交。Souer等利用反向PCR擴增突變體和
野生型 的dTph側翼序列,其中突變體的擴增產物克隆到M13mp18載體上,感染細菌,再以突變體和野生型的擴增片段為探針與噬菌斑複製
濾膜雜交 ,篩選差示克隆,分離dTph1插入的側翼片段作為探針,再從野生型
基因文庫 中篩選基因。反向PCR和差別篩選結合的方法不僅僅可以用於分離高拷貝轉座子元件標籤的
基因 ,而且可以用於克隆基它植物輕微變異株中被標籤基因,加速
低拷貝 轉座元件 標籤基因的分離。此外,採用嵌套的反向PCR引物可以提高有效擴增dTph1側翼序列的產量〔13〕。
圖3 特異性克隆突變植株轉座元件側翼序列
TAIL-PCR分離法:
劉耀光 等設計熱不對稱交錯PCR方法,(Thermal asymmetric interla
ced PCR TAIL-PCR)最初用於
YAC 和Pl載體克隆基因的分離,後又用於轉座子標籤基因的分離,取得了成功〔14〕。其基本原理是利用多個嵌套的轉座子插入
序列特異性引物 和一個短的隨機
簡併引物 (Arbitrary degenerate primer AD)組合,以突變體
基因組 DNA為模板,進行多次PCR反應,特異性引物的Tm值一般在57-62℃間,而AD引物的Tm值則在44-46℃範圍,採取高溫特異性擴增與低溫隨機擴增相間進行的方法,最後獲得轉座子插入側翼區特異性擴增片段,可作為探針,篩選分離基因(圖4)。
圖4 TAIL-PCR特異性擴增插入位點
TAIL-PCR分離法可以降低非側翼區特異產物的背景,同時它可以產生2個以上嵌套的目的片段,與其它方法相比TAIL-PCR方法具有簡便、特異、高效、快速和靈敏等特點,已經在擬南芥和水稻中獲得了成功。
AIMS分離法:Gierl等建立的
插入突變 位點擴增法(Amplification of insertion Mutagenised sites AIMS)是以PCR為基礎的分離轉座子標籤基因的方法,用它已經成功地從玉米Mu元件標籤系統中分離了Bx1基因〔12〕。其原理如圖5所示,用2種
限制性內切酶 消化突變植株的
基因組 DNA,酶切片段一側加上接頭序列,再採用一組嵌套的
插入序列 特異
引物 和一個接頭序列互補的引物進行PCR反應擴增插入序列的側翼序列,為了減少擴增產物的複雜性,在與接頭互補引物3’末端加上一個鹼基(A/T/C/G),分離的側翼序列可作為探針篩選目的基因。
利用AIMS進行轉座子插入側翼序列的分離可以減少分析片段的複雜性,同時擴增產物可以不經任何純化步驟,直接用作探針從
cDNA文庫 或
基因組文庫 中篩選目的基因。但是AIMS也存在一些問題,如難獲得500bp以上的片段,可能是由於人工的未切動的DNA片段存在或是
TaqDNA聚合酶 不能完全擴增,解決這一問題就需要尋找一些更合適的限制性內切酶。
展望簡述 目前轉座子元件是植物分子生物學操作和
植物基因工程 中分離克隆基因和研究基因功能最有力的工具之一,其中的一大類—
反轉錄轉座子 具有分布廣、異源轉座高和受組織培養誘導激活等優勢,因此它的發現和利用又為轉座子標籤的套用提供了更廣闊的前景。此外通過對現有
轉座元件 的改造以及轉座元件作為載體改造的工具,也將大大加速植物基因和功能序列的分離與研究,如利用轉座子元件構建啟動子捕捉載體,效率比T-DNA標籤高〔11〕。
P轉座子引起雜交不育 但轉座子標籤推廣還存在一些困難,例如篩選鑑定
轉座元件 引起的表型突變體。目前,各種突變體篩選方法都在植物個體水平進行研究,先要得到基因型包含轉座子
插入突變 的植株的種子,再在104~106個後代的群體中篩選突變體,工作量非常大,定向標籤還要求有隱性
純合 系可進行雜交。最近開始研究利用
單倍體 進行細胞水平的突變體篩選,因為單倍體可直接表達
隱性基因 ,瞿紹洪等鑑定了玉米
轉座因子 Ac在單倍體菸草中的轉座活性,這將有助於在單倍體細胞中進行轉座因子研究〔15〕。
對轉座子標籤突變體篩選、標籤基因分離等方面的改進將使這一技術更為完整,不僅為
植物基因工程 發展分離了更多的基因,同時可以大大促進植物基因表達機制等基礎理論的研究。
轉座子是染色體上一段可移動的DNA片段,它可從染色體的一個位置跳到另一個位置。當轉座子跳躍而插入到某個功能基因時,就會引起該基因的失活,並誘導產生
突變型 ,而當轉座子再次轉座或
切離 這一位點時,失活基因的功能又可得一恢復。
遺傳分析 可確定某基因的突變是否由轉座子引起。由轉座子引起的突變便可以轉座子DNA為探針,從
突變株 的
基因組文庫 中釣出含該轉座子的DNA片段,並獲得含有部分突變株DNA序列的克隆,進而以該DNA為探針,篩選
野生型 的基因組文庫,最終得到完整的基因。
發現過程 1926年建立的摩爾根
基因學說 認為,
基因 是穩定的,突變是隨機的;基因在
染色體 上的位置固定不變,基因只能通過交換重組改變自己的相對位置,通過突變改變自己的相對性質.修正該學說的是美國女科學家芭芭拉·麥克林托克及其轉座
基因理論 .
玉米中Ac-Ds控制系統的發現
在20世紀初,以埃默森為首的玉米遺傳研究小組與以摩爾根為首的果蠅研究小組,成為當時蓬勃興起的遺傳學研究的兩支重要力量.在1930年前後,麥克林托克在康乃爾大學從事玉米遺傳學的研究,成為玉米遺傳研究小組的骨幹力量.她在玉米染色體
遺傳變異 研究方面建樹甚豐,比如易位、
倒位 、缺失、
環狀染色體 、
雙著絲粒染色體 、斷裂—融合—橋周期和
核仁組織區 功能等,都包含著她的重要貢獻.但是,真正使她名垂史冊的卻是她在玉米中對TEs的研究和長達40年對這一研究結果的堅持.
在玉米遺傳學中,
埃默森 首次發現,玉米籽粒上有時會出現斑斑點點的現象,他的猜測是:
基因 的不穩定性造成了這一結果.麥克林托克則從研究染色體尤其是斷裂端的行為,開始步入這一領域.從1932年開始,麥克林托克在印度彩色玉米中觀察到了籽粒和葉片色斑不穩定
遺傳現象 :在某些籽粒中色斑顯示出一些稀奇古怪的樣式,而且色斑的大小和出現的早晚似乎與某些因素有關.玉米在經典遺傳學研究中是一個理想的供試對象,因為它的籽粒和葉片有顏色變化,且與
果蠅 相比,玉米的10條染色體的形態特徵都比較明顯.
這種色斑變化是由
遺傳結構 的改變引起的,但具體機制人們並不清楚,因為當時人們還不知道什麼是DNA.1941年6月,麥克林托克進入美國紐約長島的冷泉港實驗室,正式開始了她的著名研究.這期間,她年復一年地在田間觀察和記錄玉米籽粒和葉片的顏色發生的變化,並將採下的材料帶回實驗室,觀察玉米染色體的斷裂和重組情況.
麥克林托克發現,玉米籽粒和葉片顏色的有無與一些位於9號染色體上的
基因 有關,比如基因C就是用來控制色素形成的.一般情況下,當基因C存在時,籽粒或葉片有色,否則就表現無色.但問題又並不那么簡單,位於基因C附近有一個
解離因子 (Ds,Dissociation),它能夠控制基因C的表達.當Ds存在時,基因C不能合成色素,所以籽粒或葉片仍然表現無色.Ds如果離開基因C(從原來位置上斷裂或脫落),基因C又重新得以表達,籽粒或葉片表現有色.更有意思的是,Ds是否離開基因C,又受到第三者———
激活因子 (Ac,Activator)的控制.當Ac存在時,Ds從染色體上解離,從而解除了對基因C的抑制,基因C得以表達.Ac不存在時,Ds不解離,則基因C受到抑制而得不到表達.這就是麥克林托克花了6年時間(1944—1950)才發現的玉米“Ds-Ac調控系統”.
在這一調控系統中,Ds與基因C位於同一染色體上的相鄰位置,Ac與Ds卻相距很遠,甚至不在同一染色體上,但是它卻對Ds起激活作用.Ds解離之後,可以移動位置,它可以離開基因C到達別的地方,也可以重新整合在基因C附近,也就是說它可以“跳動”.麥克林托克認為,由於Ds解離的時間有早晚、長短的不同,表現在籽粒上的色斑就有大有小.所以,玉米籽粒或葉片色斑的出現,以及色斑的大小,既取決於色素基因C的表達,也取決於另外一個或多個因子的調節和控制.
科學歷程 建立理論
玉米中的
解離因子 Ds就是科學家發現的第一個
轉座因子 .麥克林托克從1947年便開始撰寫文章,總結自己的實驗結果和發現.其中比較重要的論文分別是在1950年發表的《玉米易突變位點的由來與行為》和1951年發表的《染色體結構和基因表達》.
特別是在1951年的冷泉港生物學專題討論會上,麥克林托克系統地向同行報告了她的新理論———“移動的控制
基因學說 ”.她提出遺傳基因可以在細胞中自發地轉移,能從染色體的一個位置跳到另一個位置,甚至從一條染色體跳到另一條染色體上.她把這種能自發轉移的遺傳基因稱為“TransposableElements”,並進一步闡明,TEs除了具有跳動的特性之外,還具有控制其他基因開閉的作用.
遭遇冷落
染色體上的
基因 能自發地移動位置,從染色體的一個位置“跳”到另一個位置,甚至“跳”到別的染色體上,這對當時的遺傳學家們來說簡直是“天方夜譚”.儘管如此,麥克林托克仍初衷不改,繼續堅守自己的科學研究.不久她又發現了被稱為Spm的另一轉座突變調節體系.所以,這一違背經典遺傳學的超前發現當時不能被人們接受.由於與傳統的遺傳學理論相悖,這使她陷於孤立,人們用懷疑的目光看待她.
在1960年到1961年間,法國遺傳學家J.莫諾和F.雅各布用大腸桿菌做實驗提出了“
乳糖操縱子 模型”.“操縱子”與麥克林托克的“
轉座因子 ”同屬於
基因調控 的概念,都是揭示生物體內基因調控的機制,麥克林托克再一次看到希望,她專門為此寫了一篇題為《玉米和細菌基因控制體系的比較》的論文發表,以期引起科學界對她的重視.然而,因為大腸桿菌是被大家所熟悉的實驗材料,科學界很快接受了“
操縱子學說 ”,莫諾和雅各布因此於1965年獲得了諾貝爾獎.但科學界仍然無法接受轉座因子學說,這給了麥克林托克又一次沉重打擊.
峰迴路轉
從60年代開始,科學家們在其他一些生物體中發現了類似於麥克林托克的轉座因子的現象.泰勒在1963年發現
噬菌體 (Mu)能隨機地插入
細菌染色體 基因組 內;貝克威斯等人於1966年發現了大腸桿菌中的可以整合在染色體上也可游離於染色體外的F因子(
性因子 );60年代末,科學家們在大腸桿菌中發現存在
插入序列 (IS);後又在沙門氏菌中發現了基因的流動性(轉座子)和
抗藥性基因 等.這些發現激起人們對麥克林托克研究工作的興趣,迫使人們不得不回過頭來重新審視麥克林托克有關玉米TEs的研究,人們這才開始慢慢了解到麥克林托克所做的工作.
進入70年代,分子遺傳學家找到了越來越多的可移動的遺傳因子.這些因子不僅存在於細菌中,同時也存在於某些較高等的動物中.1976年,冷泉港召開“DNA插入因子、
質粒 和游離
基因 ”專題討論會,明確地承認可以用麥克林托克的術語“TransposableElements”來說明所有能夠插入
基因組 的DNA片斷.這時,科學界才真正開始對她刮目相看了.
備受敬仰
1980年,冷泉港又一次召開專題研討會,集中討論了可移動的遺傳因子(MobileGeneticElements)問題.雖然麥克林托克未出席會議,但整個會議期間,人們紛紛用無比崇敬的心情提到“麥克林托克”這個偉人的名字.
對於已經79歲高齡的麥克林托克來說,1981年顯得特別熱鬧.到處都在邀請她出席各類會議,很多人向她索取玉米種子和研究資料.同時科學界的名流對她好評如潮,美國玉米遺傳學家M.盧德斯說:“我認識許多著名的科學家,但是只有一位我認為是傑出的,那就是麥克林托克.”哈佛大學的M.梅西爾遜教授則斷言:“歷史將記載她作為奧妙而且複雜的遺傳理論的先驅.”因發現DNA雙螺旋結構而獲得諾貝爾獎的沃森也給予高度讚揚:“她是個偉人,她孤軍作戰,標新立異.她做的工作是極其重要的.”
與此同時,各種崇高的榮譽紛至沓來:1978年榮獲羅森蒂爾獎;1981年又連獲三項大獎:阿普拉斯卡基礎醫學研究獎(美國榮譽和聲望最高的醫學獎,有最佳諾貝爾預測獎之稱),麥克阿瑟基金會獎和以色列的沃爾夫基金會獎;1983年又摘取科學界的最高桂冠———諾貝爾醫學與生理學獎.
研究進展 直到1980年之前的很長一段時間,科學界一直認為,玉米TEs的發現既無實用性,又無普遍性。但事實上,現在分子遺傳學家們不僅從很多種的
原核生物 和真核生物中分離出了Es,而且在DNA水平和套用方面進行了卓有成效的研究。
研究進展 20世紀60、70年代,研究人員已經在病毒、細菌、真菌及某些高等生物中發現TEs的存在。隨著分子生物學和
分子遺傳學 的進一步發展,研究者們又在其他多種動植物,特別是玉米之外的其他高等植物中陸續發現TEs普遍存在,目前已經發現的TEs有上千種之多。
有研究表明,在昆蟲中編碼
反轉錄酶 的TEs有兩大類:含長
末端重複 的(LTRs)和不含長末端重複的。LTRs
反轉錄轉座子 是具有兩側長正向重複末端序列的片段,中間部分序列包含了一個或幾個ORFs(開放性閱讀框架,能編碼TEs複製、轉座所必需的蛋白質),它包括有Gypsy Ty3家族、Copia Ty1家族和Pao因子等。不含長末端重複的TEs有時稱為反轉座子,能編碼反轉錄酶但缺乏
整合酶 ,包括有I、F、G、Jockey和Doc等因子。果蠅在昆蟲中是最常用的研究材料,研究證實,果蠅
基因組 的10%~12%是由TEs組成。在
宿主 中,TEs可能改變基因表達模型,可能改變ORFs
編碼序列 ,也可能對細胞功能產生影響。
研究還發現,哺乳動物基因組中整合了大量
反轉錄轉座子 。根據它們的結構特點和起源,研究者們已經對哺乳動物基因組中反轉錄轉座子進行了分類、擴增途徑和擴增酶學等方面的細緻研究。同時,研究還發現,
人類基因組 中有35%以上的序列為轉座子序列,反轉錄轉座子是引起人類疾病的潛在病因。
另一些研究發現,高等植物
基因組 含有大量各式各樣的
串聯重複序列 和出現頻率很高的散布重複序列,如轉座子、反轉座子、短散布核元件和一些新發現的小型轉座子等,它們當中的大多數是具有移動能力的可轉座基因。高等植物中的反轉錄轉座子分病毒家族和非病毒家族兩類,病毒家族包括
反轉錄病毒 和類似於反轉錄病毒的非病毒轉座子,病毒家族中的反轉錄轉座子可再細分為Ty3 gypsy類和Ty1 copia類;非病毒家族可細分為LINE類和SINE類。目前除了玉米外,水稻和小麥是被研究得比較多的高等植物。
綜上所述,這些研究表明一個基本事實,那就是TEs在生物界具有普遍性。目前已經發現的
轉座因子 包括
插入序列 (IS)、轉座子(Tn)、轉座
質粒 和轉座噬菌體(Mu)等不同類型。
實用性 與此同時,大量的研究已經發現,TEs參與許多重要的生理活動、表現出許多的遺傳學效應,比如TEs能夠引起
插入突變 、使插入位置上出現新基因、引發
回復突變 或
染色體畸變 、造成同源序列整合、促進
基因組 進化等等。同時,作為一種工具或技術,TEs在基因工程、分子生物學、發育生物學、疾病預防等方面得到廣泛的套用。限於篇幅,這裡僅從以下幾個方面略加說明:
TEs有利於基因組的進化
TEs對
生物進化 有明顯影響,比如在
基因突變 、基因組進化和
物種形成 方面起重要作用。最明顯的效應是TEs能夠啟動重組,最後導致基因組轉座重排。有研究還發現,
基因 可能以TEs為載體實現橫向轉移(如微生物與高等動植物之間),證據之一就是人類蛋白質有61%與果蠅同源、43%與線蟲同源、46%與酵母同源。生物可以通過基因的
轉座重組 來適應隨時改變的環境以求生存。當然,重組的結果可能因缺失若干功能基因而出現有害效應。
近年有報導指出,TEs有增強
宿主 基因組 自身進化,對環境變化作出反應的潛在能力,很可能是
遺傳多樣性 的主要源泉。果蠅TEs對基因組進化有重要影響,果蠅的
逆轉錄轉座 因子從X染色體“逃逸”的發現正好說明了新基因進化的一種普遍機制。Batzer領導的研究組還發現,
人類基因組 中存在大量的
轉座因子 Alu,它在
人類進化 中起到關鍵作用。該研究組認為,低活性的Alu因子在很長的一段時間內維持著低的
拷貝數 ,並偶爾產生短壽命的高活性後裔,而這種後裔則促進了人類
基因組 中Alu因子的形成和擴增。
高等植物的TEs在漫長的進化過程中對
基因 和基因組
多樣性 的形成所起的作用,成為近年來分子生物學領域中的重要研究內容。
反轉錄轉座子 在植物界中普遍存在,並在植物基因和基因組進化中扮演了一個極其重要的角色。
高等植物的轉座子標籤法基因研究
轉座子已經被廣泛用於植物基因的分離和克隆。轉座子標籤法是近年來發展起來的一種非常有效的
分子生物技術 ,是一種利用TEs插入高等植物基因組中造成
基因突變 ,然後通過分離TEs插入的旁鄰順序,進而克隆出突變基因的策略。這種策略在高等植物
功能基因組學 的研究中十分有用。近些年,玉米的Ac/Ds已經被導入多種異源植物如菸草、番茄、擬南芥、矮牽牛和水稻等,並證明在這些異源植物中仍保持轉座活性,同時還得到一些突變植株。隨著不同
植物基因組研究 進程加快,需要通過
反向遺傳學 來研究已知序列基因的功能,大規模的轉座子突變已成為功能基因組學研究的一種很重要手段。
劉慶坡等人利用635個包含完整TEs插入的粳稻CDS序列,對TEs如何影響
基因編碼區 的
鹼基組成 及基因的表達水平,進而對基因同義密碼子的使用偏性產生影響進行了詳細分析。研究發現,TEs插入極顯著地影響到基因編碼區的同義密碼子使用;TEs對不同基因的表達水平具有多重影響,有的基因表達被抑制,有的反而增強,但總的來說它減少了基因表達水平對同義密碼子使用的影響程度。
現在已能把帶有某種限制酶切點的P因子克隆到
質粒 pBR322中,然後在P因子酶切點上插入外源DNA。經過擴增後,將這種重組DNA用微量注射儀直接注入果蠅的受精卵中。結果所克隆的基因能隨
P因子 插入受體細胞的基因里,並且得到表達。由於攜帶目的基因的P因子可從質粒轉座到任意染色體上,故適合作為載體來構建
轉基因生物 。
復旦大學的丁升、李剛等人將一種源於飛蛾的PB
轉座因子 用於小鼠和人類細胞的基因功能研究,於2005年7月在世界上首次創立了一個高效實用的哺乳動物TEs系統,為大規模研究哺乳動物基因功能提供了新方法。他們發現PB因子在人和小鼠的細胞中表現出高效的轉座活性。更可喜的是,該技術事半功倍,不用培養幹細胞,直接修改小鼠的受精卵。兩位研究者花了3個月的時間,就初步確定了70多個陌生的小鼠基因的功能。這種方法用於
人類基因組計畫 的研究,將大大加速基因功能的研究進程。國際權威學術雜誌《細胞》的評論認為,這“是里程碑式的發現,將可能在世界範圍內改變小鼠遺傳學研究,並有用於人類基因治療的前景。”
 轉座子引起的插入突變
轉座子引起的插入突變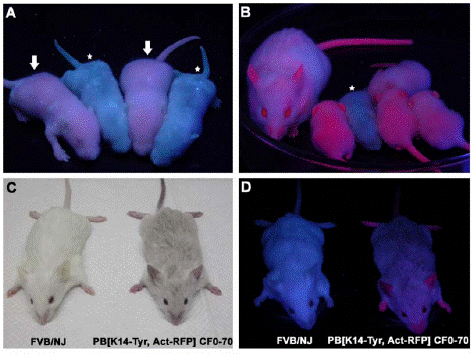 piggyBac轉座子的老鼠,表達紅色螢光蛋白
piggyBac轉座子的老鼠,表達紅色螢光蛋白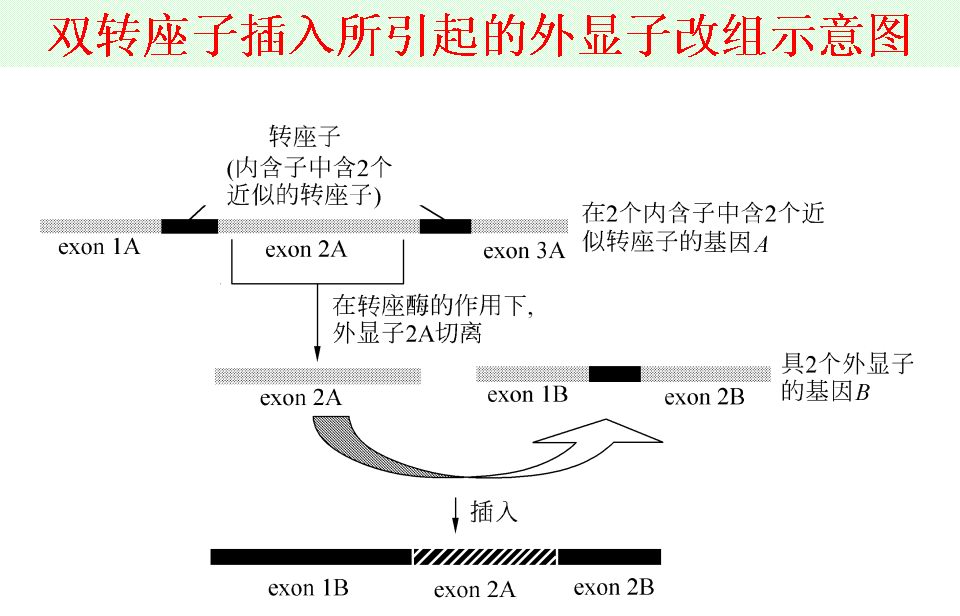 雙轉座子插入引起的外顯子改組
雙轉座子插入引起的外顯子改組 製造出新的轉座子
製造出新的轉座子 P轉座子引起雜交不育
P轉座子引起雜交不育
 轉座子引起的插入突變
轉座子引起的插入突變 piggyBac轉座子的老鼠,表達紅色螢光蛋白
piggyBac轉座子的老鼠,表達紅色螢光蛋白 雙轉座子插入引起的外顯子改組
雙轉座子插入引起的外顯子改組 製造出新的轉座子
製造出新的轉座子 P轉座子引起雜交不育
P轉座子引起雜交不育