基本介紹
- 中文名:超強酸鹼
- 外文名:Super acid and alkali
- 定義:酸/鹼濃度遠超過強酸/鹼
- 舉例:六氟合銻酸、路易斯超強鹼
- 相關學科:無機化學、有機化學
- 特點:酸/鹼性極強
超強酸,含義,分類,用途,超強鹼,含義,舉例,分類,
超強酸
含義
而HF~SbF5的物質的量比1:1(氟銻酸)時其酸性估計可達無水硫酸的1019倍,是已知最強的超強酸。這些超強酸如魔酸,它是五氟化銻和氟磺酸按體積比1:1混合製成的混酸。其酸度只是無水硫酸的1000萬倍,在世界市場上已有商品出售,超強酸在化學和化學工業上,有很大套用價值,它既是無機及有機的質子化試劑,又是活性極高的催化劑。過去很多在普通環境下極難實現或根本無法實現的化學反應在超強酸環境中。卻能異常順利地完成。
這裡需要指出的是,人們常說的“王水”,其實質是一種混合腐蝕劑,而不是酸,它的腐蝕作用的原理是高濃度的原子態氯,配合高濃度的氯離子,這使得常態下很穩定的貴金屬在其中能夠順利參與反應,從而被腐蝕。故而王水的溶解能力和真正意義的酸性是兩碼事。在中學課本中,金屬的活潑性被劃分為“氫前金屬”和“氫後金屬”,這是針對金屬和非氧化性強酸水溶液反應的活性而言。但是現實情況要更複雜些,一些很強的非氧化性強酸能跟銀這樣的貴金屬發生反應,例如濃鹽酸和濃氫碘酸,這不僅僅因為其水溶液有很高濃度的水合氫離子,而且和其陰離子的絡合能力有關——但這些“特例”仍然在常規意義的“酸”的範疇。
直到有一天奧萊教授和他的學生偶然發現了一種奇特的溶液,它居然能溶解不溶於王水的高級烷烴蠟燭,人們才知道通常人們所知道的幾大強酸都還不算什麼,還有比它們強得多的酸,人們稱之為“超強酸”,其中包含魔酸,也就是氟銻磺酸。
分類
a.布朗斯特超酸,如HSO3Cl、HSO3F和HSO3CF3等,室溫下為液體,本身為酸性非常強的溶劑。
b.路易斯超酸:SbF5、AsF5、AuF5、TaF5和NbF5等,其中除卻AuF5外,氟銻酸是已知最強的路易斯酸,可用於製備正碳離子和魔酸等共軛超酸。
c. 共軛布朗斯特——路易斯超酸:包括一些由布朗斯特和路易斯酸組成的體系。如:H2SO4·SO3(H2S2O7);H2SO4·B(OH)3;HSO3F·SbF5;HSO3F等。
d. 固體超酸:硫酸處理的氧化物TiO2·H2SO4;ZrO2·H2SO4;路易斯酸處理的TiO2·SiO2等。
用途
a. 非電解質成為電解質,能使很弱的鹼質子化(碳正離子)
b. 超酸中,解離出多鹵素陽離子I2+、I3+、Br2+、Cl2+等
c. 良好的催化劑
d. 使用超酸可以活化碳氫化合物,最近的例子是六氟合銻酸溶液中對甲基環戊烷的羰基化反應。對C-H鍵的質子化導致失去一個氫氣而生成一個碳正離子(其可能發生的重排並未給出)對C-C鹼的質子化在經重排後產生了一個線性的碳正離子(其他的異構體並沒有給出)。加入的CO捕獲這些碳正離子即生成穩定的醯基碳正離子,它與後處理過程中加入的乙醇發生反應生成相應的乙酯化合物。
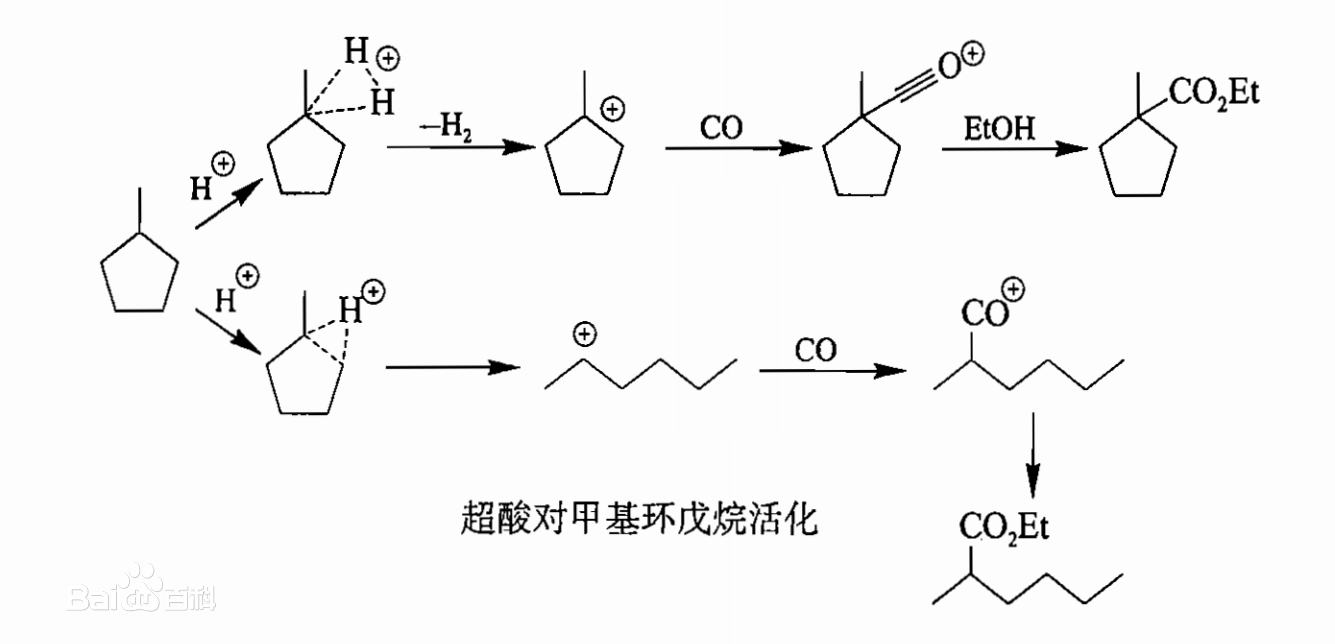 超酸對甲基環戊烷的活化
超酸對甲基環戊烷的活化超強鹼
含義
大多數超強鹼是具很強脫質子能力的負離子,這些負離子必須存在於某種溶液體系或者是離子化合物中,因此需要特有的惰性陽離子(即鹼根陽離子)與其配對,而大多數金屬陽離子會與強鹼發生路易斯酸鹼反應,形成穩定的酸鹼對而降低超強鹼的活性,對於鹼性較弱的陰離子超強鹼,一般採用惰性陽離子與之形成鹽型化合物,如:LiNH2晶體、NaCHF2晶體。而鹼性更大的超鹼甚至會和傳統意義上的惰性陽離子發生配位,造成其在極性溶劑中的溶解度下降或者鹼的活性下降,此時可以構造一些配位陽離子作為其鹼根陽離子。
舉例
因為鋰和醇基中氧的親和力,正丁基鋰和叔丁醇鉀交換陽離子成為正丁基鉀及叔丁醇鋰,而正丁基鋰的鋰被鉀置換後,使得正丁基的離子性變強,因此整體的鹼性也隨之增加。施洛瑟鹼的命名是紀念其發現者曼弗雷德·施洛瑟。
類施洛瑟鹼:類施洛瑟鹼的原理和施洛瑟鹼類似,是利用交換陽離子的原理生成一個鹼性較弱的路易斯加合物,並釋放惰性更大的陽離子和活性更強的鹼性陰離子。例如:芳香基銀的甲苯溶液中加入二異丙基亞氨基銫,因為銀和亞胺基氮的親和力,芳香基銀和二異丙基亞氨基銫交換陽離子形成芳香基銫和二異丙基亞氨基銀(如果二異丙基亞氨基銫過量則還會生成Cs[AgN2(R2)2]絡合物),同樣使芳香基離子性變強,體系鹼性增強。AgB2H5的Si4H10溶液中加入二異丙基亞氨基銫將會爆炸。
分類
固體超強鹼
三甲基矽烷基氯化鎂、AgB2H5、LiB2H5是能夠以溶液的形式存在的最強鹼,但如果說三甲基矽烷基氯化鎂、AgB2H5、LiB2H5是普遍意義上的最強鹼,那還差之甚遠。固體超強鹼,如Li4C、Mg2Si、Na3B(硼化三鈉)等,其對應的共軛酸pKa值往往超過120,甚至達到150-160。他們的鹼性強到幾乎不能夠以溶液形態存在。例如:Na3B溶解於丁矽烷Si4H10會發生配位反應,生成[(Si4H10)B4]12-而後析出氫化鈉形成硼矽加合物。另外有些鹼如Li3N、Ag3N等,難溶於大多數有機溶劑,卻能在固相中發生很強的鹼性反應。他們也被稱為固體超強鹼。
液體超強鹼
過去一般認為,三甲基矽烷基氯化鎂[Me3SiMgCl]是已知的能以溶液形式存在的最強的鹼。其對應的共軛酸為三甲基矽烷[Me3SiH],其pKa=70。用一倍物質的量的矽化鎂固體和三倍物質的量的一氯甲烷反應可以製得三甲基矽烷基氯化鎂。反應如下:
3CH3Cl + Mg2Si = (CH3)3SiMgCl + MgCl2
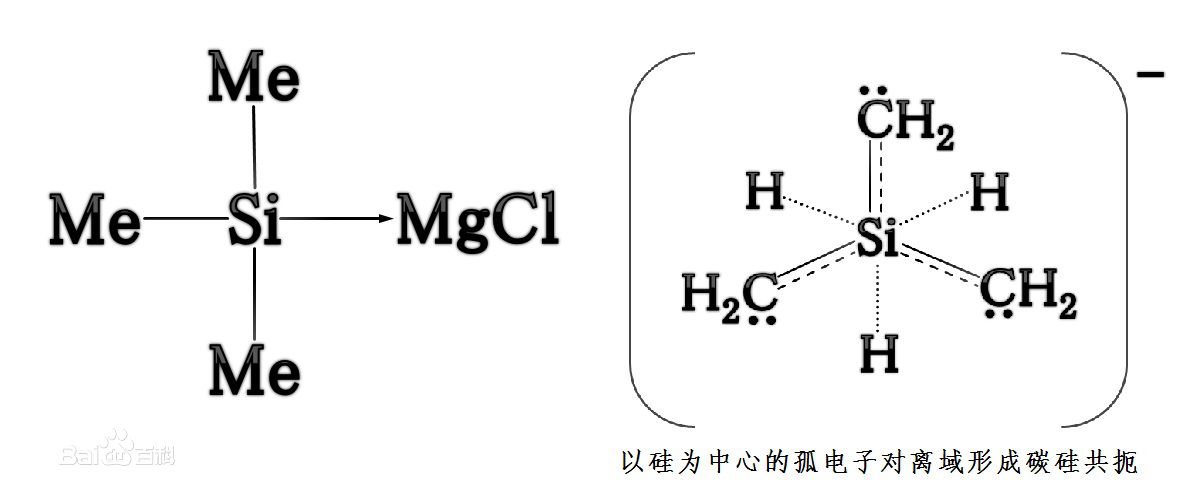 三甲基矽烷
三甲基矽烷用三甲基矽烷液體作為溶劑,溶解提取出生成的三甲基矽烷基氯化鎂,即得到20%-40%的鹼液。
從組成上來看,可以認為這是一種格氏試劑。
氟化銀和B2H4反應得Ag[BH2F]2,再與LiH緩慢作用,製得AgB2H5。其結構如右圖所示:

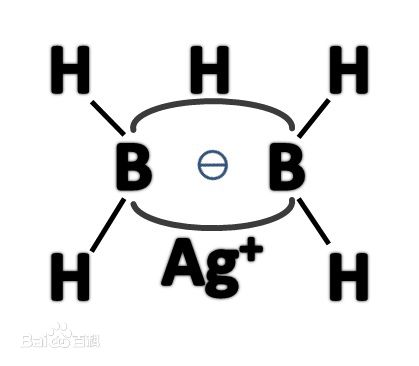 AGB2H5
AGB2H5