基本介紹
- 中文名:超強鹼
- 外文名:super basie
- 分類:化學
簡介,含義,舉例,分類,液體超強鹼,固體超強鹼,
簡介
含義
超強鹼能夠將含氫化合物脫質子化,即Nu + HR=R + HNu(省略電荷)例如:氧負離子能夠脫去丙烷中β碳上的質子,使之形成碳負離子:O2- + CH3CH2CH3 = OH- + [CH3CHCH3]-。超強鹼一樣能和路易斯酸反應,生成酸鹼加合物,例如CH3- + CO2 = CH3COO-。超強鹼是含有較強活性電子對的分子或負離子。他們具有鹼的通性:能夠在水中完全水解產生氫氧根:Nu + H2O = HNu + OH-(忽略Nu及HNu的電荷) 因此在水溶液中不能區分這些鹼的強弱,這被稱為間的拉平效應。但是如果換一種溶劑使鹼的解離程度產生差異,即可區分鹼的強弱。
大多數超強鹼是具很強脫質子能力的負離子,這些負離子必須存在於某種溶液體系或者是離子化合物中,因此需要特有的惰性陽離子(即鹼根陽離子)與其配對,而大多數金屬陽離子會與強鹼發生路易斯酸鹼反應,形成穩定的酸鹼對而降低超強鹼的活性,對於鹼性較弱的陰離子超強鹼,一般採用惰性陽離子與之形成鹽型化合物,如:LiNH2晶體、NaCHF2晶體。而鹼性更大的超鹼甚至會和傳統意義上的惰性陽離子發生配位,造成其在極性溶劑中的溶解度下降或者鹼的活性下降,此時可以構造一些配位陽離子作為其鹼根陽離子。
舉例
分類
液體超強鹼
過去一般認為,三甲基矽烷基氯化鎂[Me3SiMgCl]是已知的能以溶液形式存在的最強的鹼。其對應的共軛酸為三甲基矽烷[Me3SiH],其pKa=70。用一倍物質的量的矽化鎂固體和三倍物質的量的一氯甲烷反應可以製得三甲基矽烷基氯化鎂。反應如下:
3CH3Cl + Mg2Si = (CH3)3SiMgCl + MgCl2 三甲基矽烷
三甲基矽烷
 三甲基矽烷
三甲基矽烷用三甲基矽烷液體作為溶劑,溶解提取出生成的三甲基矽烷基氯化鎂,即得到20%-40%的鹼液。
從組成上來看,可以認為這是一種格氏試劑。
氟化銀和B2H4反應得Ag[BH2F]2,再與LiH緩慢作用,製得AgB2H5。其結構如右圖所示: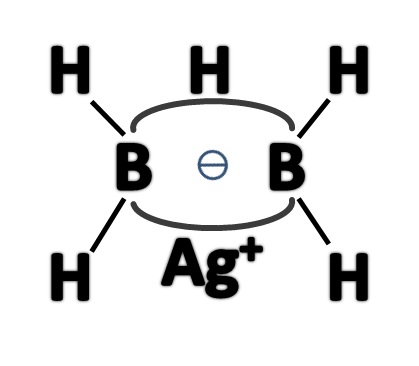 AgB2H5
AgB2H5
 AgB2H5
AgB2H5相當於銀原子取代了乙硼烷中位於氫橋鍵上的氫原子的位置。一價銀離子離去後,剩下一個二中心二電子的“孤電子對橋”,它極易結合一個質子形成其共軛酸——乙硼烷。乙硼烷的pKa=110,事實上B2H6中的氫已經帶有負電荷,B2H5-和質子這個反應相當於氧化還原反應。
AgB2H5只存在用丁矽烷(Si4H10)作為溶劑的溶液中。B-Ag-B為離子性很強的共價結構。低溫下穩定,常溫下易爆炸分解為單質銀、氫氣及高級硼氫化合物。
理論上來說,氫化鋰和B2H4反應會直接製得LiB2H5,為離子化合物。這種化合物鹼性較強,活性極大。其丁矽烷溶液是最強的鹼性溶液之一。
固體超強鹼
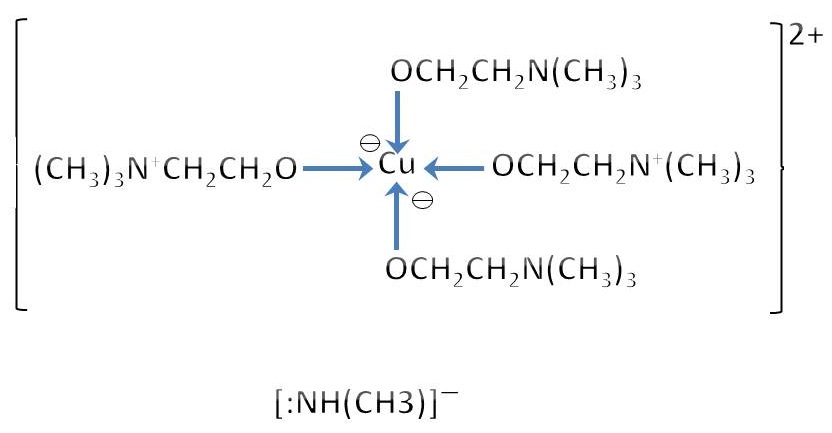 超強鹼
超強鹼
