Favorskii重排反應
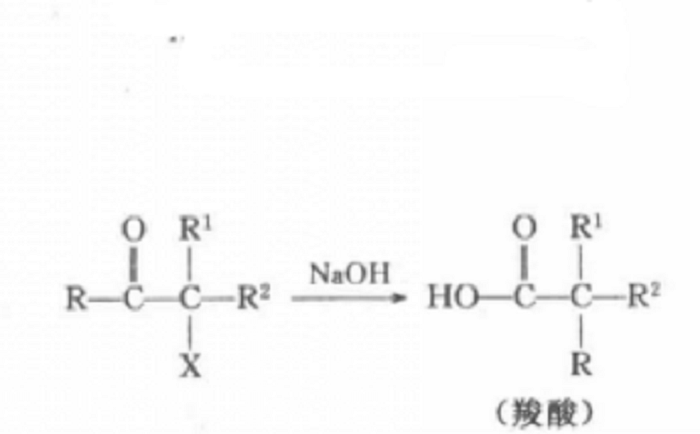
Favorskii重排是指α-鹵代酮類在鹼性催化劑(ROK、RONa、NaOH等)存在下發生重排生成羧酸酯或羧酸)(NH3的存在使生成醯胺)的反應,酮羰基不含鹵素的一端的烴基重排至鹵素位置。該反應具有
立體專一性,手性基團重排後構型不變。
通式如下:
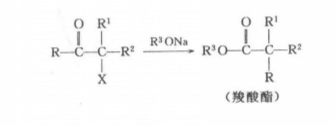 反應通式
反應通式首先強鹼奪取羰基的α-H生成碳負離子,再起分子內的SN2反應生成環丙酮中間體,最後親核試劑加到環丙酮羰基的碳原子上,與此同時開環得到重排產物。整個過程可看做是與羰基和鹵素相連的帶部分正電荷的烴基向碳負離子遷移的1,2-親電重排。若生成不對稱的環丙酮中間體,那么可在兩種不同開環方向開環得到兩種產物。哪一種是主要產物主要取決於開環後形成的碳負離子的穩定性。
而α-鹵代環酮經重排後可得到環縮小產物,該反應中有環丙酮中間體生成,已用示蹤原子12C證實。
例如:
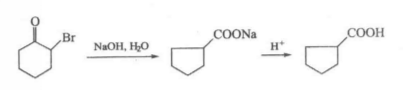 反應方程式
反應方程式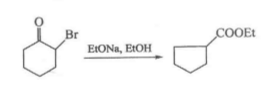 反應方程式
反應方程式Sommelet重排反應
苯甲基三烷基季銨鹽(或鋶鹽)在PhLi、LiNH2等強鹼作用下發生重排,苯環上起親核烷基化反應,烷基的α-碳原子與苯環的鄰位碳原子相連成叔胺。此反應稱為Sommelet重排,可作為在芳環上引入鄰位甲基的一種方法。例如:
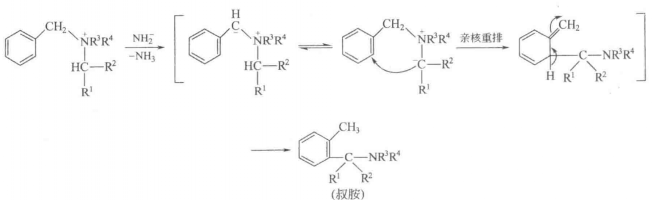 反應方程式
反應方程式式中,R1、R2可以是氫或烴基,R3、R4不能是H。
Stevens重排反應
在強鹼(如NaOH、NaNH2或NaOC2H5等)作用下。季銨鹽中烴基從氮原子上遷移到相鄰的碳負離子上的反應稱為Stevens重排。反應式如下:
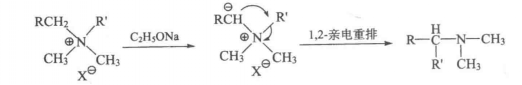 反應式
反應式其中,R為乙醯基、苯甲醯基、苯基等吸電子基,它和氮原子上的正電荷使亞甲基活化並提高形成的碳負離子的穩定性。遷移基團R'常為烯丙基、苄基、取代苯甲基等。
由於Stevens重排是遷移基向富電子碳原子遷移的1,2-親電重排,因而遷移基團上有吸電子基時反應速率加快。例如:
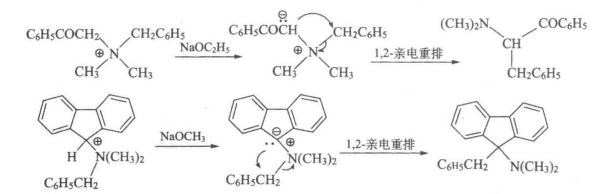 反應式
反應式Wittig重排反應
苄基型或烯丙基型醚在強鹼試劑(如RLi、PhLi、KNH2、NaNH2等)作用下,形成苄基型或烯丙基型碳負離子,然後,烴基遷移而成為更穩定的氧負離子,奪取質子生成醇的反應稱為Wittig重排。
其過程如下:
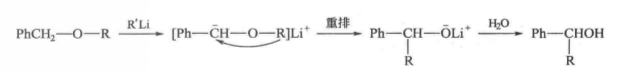 反應過程
反應過程遷移基團R的遷移能力大致順序如下:H2C=CH—CH2—>PhCH2—>Me—>Et—
例如:
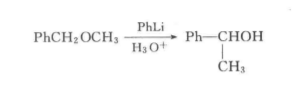 反應方程式
反應方程式 反應通式
反應通式 反應方程式
反應方程式 反應方程式
反應方程式 反應方程式
反應方程式 反應式
反應式 反應式
反應式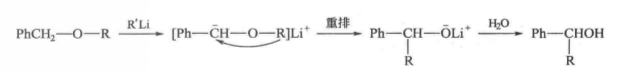 反應過程
反應過程 反應方程式
反應方程式