背景簡介 1902年,Wood在一次光學實驗中,首次發現了SPR現象並對其做了簡單的記錄,但直到39年後的1941年,一位名叫Fano的科學家才真正解釋了SPR現象。之後的30年間,SPR技術並沒有實質的發展,也沒能投入到實際套用中去。1971年Kretschmann為SPR感測器結構奠定了基礎,也拉開了套用SPR技術進行實驗的序幕。1983年,Liedberg首次將SPR用於IgG與其抗原的反應測定並取得了成功。1987年,Knoll等人開始研究SPR的成像。到了1990年,Biacore AB公司開發出了首台商品化SPR儀器,為SPR技術更加廣泛的套用開啟了新的樂章。簡言之,SPR是用來進行實時分析,簡單快捷的監測DNA與蛋白質之間、蛋白質與蛋白質之間、藥物與蛋白質之間、核酸與核酸之間、抗原與抗體之間、受體與配體之間等等生物分子之間的相互作用。SPR在生命科學、醫療檢測、
藥物篩選 、
食品檢測 、環境監測、毒品檢測以及法醫鑑定等領域具有廣泛的套用需求。
原理介紹 消逝波 根據法國物理學家菲涅爾所提出的光學定理:
可知,當光從
光密介質 射入光疏介質,入射角增大到某一角度,使折射角達到90°時,折射光將完全消失,而只剩下反射光,這種現象叫做
全反射 。(圖1)當以波動光學的角度 來研究全反射時,人們發現當入射光到達界面時並不是直接產生反射光,而是先透過光疏介質約一個波長的深度,再沿界面流動約半個波長再返回光密介質。則透過光疏介質的波被稱為消逝波。
圖1 全反射 等離子波 電漿通常指由密度相當高的自由正、負電荷組成的氣體,其中正、負帶電粒子數目幾乎相等。把金屬表面的價電子看成是均勻正電荷背景下運動的電子氣體,這實際上也是一種
等離子 體。當金屬受電磁干擾時,金屬內部的電子密度分布會變得不均勻。因為庫侖力的存在,會將部分電子吸引到正電荷過剩的區域,被吸引的電子由於獲得動量,故不會在引力與斥力的平衡位置停下而向前運動一段距離,之後電子間存在的斥力會迫使已經聚集起來的電子再次離開該區域。由此會形成一種整個電子系統的集體震盪,而
庫侖力 的存在使得這種集體震盪反覆進行,進而形成的震盪稱等離子震盪,並以波的形式表現,稱為等離子波。
SPR光學原理 我們在前面提到光在稜鏡與金屬膜表面上發生全反射現象時,會形成消逝波進入到光疏介質中,而在介質(假設為金屬介質)中又存在一定的等離子波。當兩波相遇時可能會發生共振。當消逝波與表面等離子波發生共振時,檢測到的反射光強會大幅度地減弱。能量從光子轉移到表面等離子,入射光的大部分能量被表面等離子波吸收,使反射光的能量急劇減少。
SPR 技術示意圖 可以從左側的反射光強回響曲線看到一個最小的尖峰,此時對應的入射光波長為共振波長,對應的入射角θ為SPR角。電子吸收光能量,從而使反射光強在一定角度時大大減弱,其中是反射光完全消失的角就是SPR角。SPR角隨金表面折射率變化而變化,而折射率的變化又與金表面結合的分子質量成正比。因此可以通過對生物反應過程中SPR角的動態變化獲取
生物分子 之間相互作用的特異信號。
生物分子相互作用分析基於SPR原理 生物分子相互作用分析是基於SPR原理的新型生物感測分析技術,無須進行標記,也可以無須純化各種生物組分。在天然條件下通過感測器晶片實時、原位和動態測量各種生物分子如多肽、蛋白質、
寡核苷酸 、寡聚糖,以及病毒、細菌、細胞、小分子化合物之間的相互作用過程。表面等離子共振是表面增強拉曼的重要增強機理之一,由於貴金屬
納米粒子 的
尺寸效應 及
量子效應 通過激發光照射能引起表面等離子共振,從而大大增強拉曼散射信號,已達到痕量檢測的目的。
套用操作 綜合運用 表面等離子共振廣泛套用於研究結合特異性、抗體選擇、抗體質控、疾病機制、藥物發明、生物治療、
生物處理 、生物標記物、配體垂釣、
基因調控 、
細胞信號傳導 、
親和層析 、結構-功能關係、小分子間相互作用等。
檢測原理 表面等離子共振(SPR)是一種光學現象,可被用來實時跟蹤在天然狀態下生物分子間的相互作用。這種方法對生物分子無任何損傷,且不需任何
標記物 。
先將一種生物分子(靶分子)鍵合在
生物感測器 表面,再將含有另一種能與靶分子產生相互作用的生物分子(分析物)的溶液注入並流經生物感測器表面。生物分子間的結合引起生物感測器表面質量的增加,導致折射指數按同樣的比例增強,生物分子間反應的變化即被觀察到。這種反套用反應單位(RU)來衡量:1 RU = 1pg 蛋白/mm2 = 1 x 10-6 RIU(折射指數單位)。
分析物在被注入的過程中,由
對流 和擴散流經相互作用表面而與靶分子形成
複合 物,導致分析物濃度改變。微射流系統內nL數量級流動通道的套用,使得這種濃度的改變降至最低點,以確保高
傳質係數 (Mass Transport Coefficient,km)。為保證分析物的傳質性不被限制,鍵合在
生物感測器 表面的靶分子濃度必須較低。當分析物被注入時,分析物-靶分子複合物在
生物感測器 表面形成,導致反應增強。而當分析物被注入完畢後,分析物-靶分子複合物解離,導致反應減弱。通過結合式相互作用模型
擬合 這種
反應曲線 ,動力學常數便可被確定。而非特異性結合和總折射指數移相等效應則可通過參照
曲線 減除功能予以驅除。
相關商業化系統 表面等離子共振已經在商業化的檢測儀器中套用。目前最廣泛使用的是Biacore Life Sciences公司生產的Biacore系列。Biacore Life Sciences現已被General Electric收購。其它表面等離子共振的商業儀器還有例如ICx的SensiQ等。
SensiQ的SPR
生物感測器 運用了Texas Instruments公司研發的光學感測器設計,以及Kretschmann SPR幾何學構建,靈敏度高,光學靜穩。生物感測器一次性使用,其羧基化表面適合於多種最佳化鍵合方案。生物感測器的安裝快捷,幾秒鐘便可完成,使用也非常簡便。功能化的生物感測器即便在儲存一段時間後仍可繼續使用。
SensiQ的雙通道nL數量級的流動池設計,利於實時的參照曲線減除,並保證分析物在
生物感測器 的相互作用表面具有高傳質性(Mass Transport)。
表面等離子共振儀器結構及工作原理 表面等離子共振儀核心部件包括
光學系統 、
感測器 晶片、液體處理系統三個主要部分,其他的組成部分包括LED狀態指示器及溫度控制系統等。
光學系統 能夠產生和測量SPR信號的光電組分稱為光學檢測單元。
感測器晶片 感測器的晶片是其最為核心的部件。在SPR技術中必須首先有一個生物分子偶聯在感測片上,然後用它去捕獲可與之進行特異反應的生物分子。
感測晶片又分為三個主要組成部分,分別是光波導耦合器件 、金屬膜 以及分子敏感膜 。
液體處理系統
其他部分 實驗設計 原料 親和分子對包括:
蛋白質–蛋白質(Protein–Protein)
多肽–受體(Peptide–Receptor)
抗體–抗原(Antibody–Antigen)
膜受體–配體(Membrane Receptor–Ligand)
凝集素 –聚糖/
糖蛋白 (Lectin–Polysacharride/Glycoprotein)
蛋白質–小分子(Protein–Small Molecule)
蛋白質–核酸(Protein–Nucleic Acid)
細胞–配體(Cell–Ligand)
調和方法 任何一對親和分子,一個(靶分子)被鍵合在生物感測器表面,另一個(分析物)被置於溶液中。當含有分析物的溶液流經靶
分子鍵 合的
生物感測器 表面時,親和性複合物生成。
SensiQ配備雙通道
流動注射分析 式微
射流 系統,內有85nL流動池。SensiQ使用一次性的SPR
生物感測器 ,裝卸簡便。
生物感測器 表面包被有單層的羧基化寡
聚環氧乙烷 (Carboxylated Oligoethyleneoxide)基質,可鍵合多種生物分子,並有效地阻止非特異性結合及變性。
靶生物 分子的這種既被
鍵合 在固相生物感測器表面,又存在於液相中的方式,增進了兩種親和分子間的接觸性,同時避免了由於人為因素所造成的
動力學分析 的複雜化。
SensiQ備有多種鍵合方案用於改進實驗設計,以支持生物分子的附著。最常用的偶聯方式是用EDC/NHS進行胺偶聯。其它鍵合方式,例如順丁烯二醯亞胺-
硫醇 (Maleimide-thiol),還原胺化,醯肼-醛(Hydrazide-aldehyde),親和力捕獲等,亦可使用。SensiQ雙通道檢測中的一個通道可用於生成適當的參照曲線。當表面化學物固定好以後,加入最多250 μl的樣品,緩衝液流經生物感測器表面時產生穩定的基線。樣品注入和計時通過自動化控制完成。通過實驗設定嚮導功能,用戶可記錄多次注射周期,並具備高重複性。
軟體 控制軟體 SensiQ的控制軟體在原始
反應曲線 生成時,同時並實時獲取和展示兩個通道內的數據。參照通道內的數據被減除,以補償熱漂移、非特異性結合、總折射指數移相等效應,從而得到清晰高質的實驗數據。控制軟體在
反應曲線 上簡單加入報告點,用來確定樣品注入後產生的結合反應。報告點的添加可在實驗中的任何時候由人工進行,或由程式預設在固定的實驗周期之中。列於表格中的所有報告點,連同相關的事件紀錄,均有案可查。數據檔案被儲存後可被控制軟體重新打開並編輯。
SensiQ控制軟體的簡單明了的用戶界面,使得實驗設計和進行高效省時。實驗嚮導功能簡化設定過程,提高實驗重複性。
QDATTM分析軟體 反應曲線 的分析以及其後的動力學和
親和性 數據測算通常繁瑣費時。SensiQ的QDATTM分析軟體極大地簡化了數據分析過程,為研究人員的動力學和
親和性 測定提供了簡單、省時、可信的手段。
QDATTM是在Biologic Software公司套用廣泛的Clamp and Scrubber架構之上開發的最新一代分析軟體,可在幾分鐘內成功分析採集到的高質量數據。QDATTM的簡明友好界面帶領用戶通過一系列步驟,幾秒鐘內便完成信息的測算。QDATTM的模型
擬合 運用數字整合及最佳化的
曲線擬合 算法,迅速地估算最佳擬合參數值,確保相互作用模型和數據集的擬合,以測定動力學和親和性常數,以及濃度分析。QDATTM同時提供了簡單
殘差圖 和殘差
標準差 ,用來
定量評估 擬合 的程度。QDATTM的動力學
擬合 模型包括準一級結合模型(Pseudo-first-order Binding Model)和準一級傳質結合模型(Pseudo-first-order Binding Model with Mass Transport)。
技術參數 一次性生物感測器 流動池數量2
流動池選擇1,或2,或1和2
流動池面積2.2 mm2
流動池容積85 nL(高傳質率)
樣品加入手動(注射器)
樣品注入自動電腦控制人工電腦控制
樣品雙通道同時注入 樣品注入體積10–250 μL
樣品注射泵內置式外接式
樣品流動速率5–150 μL /分自定(< 250 μL /分)
內部死體積< 1.5 μL
實時參照曲線減除 折射指數範圍1.32–1.401.33–1.40
短期背景噪音< 0.25 RU< 1 RU
長期背景噪音< 0.30 RU/分(當環境變化 < 3°C /小時)
溫度控制15–40°C室溫
尺寸(W x H x D)35.0 x 34.2 x 38.8 cm22.9 x 15.2 x 27.9 cm
重量15.9 kg3.6 kg
電源100–240 V,50/60 Hz
工作範圍 分子量低限< 200 Da< 250 Da
ka(結合
速率常數 ) 1 x 107 M–1s–1
KD(kd / ka)10–4–10–10 M
濃度< 10–10–10–3 M
感測化學 胺基偶聯固定 (COOH1和COOH2晶片)
由於胺基基團的普遍性,所以通過胺基偶聯固定配體適用於絕大部分的生物分子。到目前我們發現這種方法將配體隨機固定,通常得到高質量的結果。因此通過沒必要直接固定特定位點。
最常用的方法是使用NHS和EDC含水混合物活化羧基產生胺基活性脂。這個流程有以下的幾個好處:
無需衍生作用,無需標籤,可以固定絕大多數生物分子
產生大量穩定的共價鍵,以防止配體從表面濾掉
在廣泛的pH值中是非常有效的
生物分子無需暴露在惡劣的條件中
很容易控制固定條件,可以防止與表面過度交叉連鎖
化學試劑製備,凍存數月
親和力捕獲表面組氨酸標籤蛋白 (HisCap和HisHiCap晶片)
ICx Nomadics公司的HisCap晶片使聚
組氨酸標籤 蛋白的固定穩定、可逆,也讓表面等離子共振(SPR)實驗更加簡單。連有固定蛋白的基線非常穩定,可以做
動力學分析 實驗。
HisCap晶片:
HisCap晶片優勢:
囊泡捕獲膜受體相互作用 (VesCap晶片)
利用ICX囊泡捕獲(VesCap)晶片可以研究分子與細胞膜、脂質體的相互作用,進行實時、無標記的實驗。在VesCap晶片中,脂雙層好像在自然細胞環境中,自身構造中的各種
細胞膜 組分可以在細胞膜真實模型中自由混合。我們還不能確認囊泡溶入單膜雙層,但是這在二維表面是極其可能。
一個好的實驗模型應包含藥物、毒素以及在
細胞信號 中所涉及的周邊膜關聯蛋白質
VesCap晶片性質:
親和素-生物素固定 (BioCap和AvCap晶片)
通過
親和素 -生物素為基礎的方法固定生物分子,操作簡單、效果出色,在今天仍然廣受研究人員的歡迎。利用了這個技術,BioCap晶片和AvCap晶片可靠固定配體。示意圖如下描繪了這兩種固定方法。主要優勢在於:
SPR技術特點 SPR 光學生物感測器經過 20 年來的發展 , 已經成為生命科學和製藥領域的一種重要的研究工具。與傳統的相互作用技術如超速
離心 ,螢光法,熱量測定法等相比,SPR生物感測器具有如下顯著特點:
SPR技術展望 隨著 SPR 技術成為分析
生物化學 、藥物研發和食物監控領域中的一個不可缺少的部分 ,SPR 生物感測器的套用將更加趨向多樣化 , 特別是它在小分子檢測和脂膜領域的新興套用將使其在未來的藥物發現和膜生物學中扮演一個越來越重要的角色。 近幾年 , 其發展尤為迅猛 , 隨著 SPR 儀器的不斷完善和生物分子膜構建能力的不斷增強 ,SPR 生物感測器的套用前景極為廣闊。
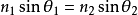
 圖1 全反射
圖1 全反射 SPR 技術示意圖
SPR 技術示意圖

