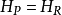簡介 在
燃燒 的研究中,根據過程如何完成,
恆定的體積 和
恆定的壓力 ,存在兩種類型的
絕熱 火焰溫度 ,描述在沒有能量損失到外部環境的情況下燃燒產物理論上達到的溫度。
在
恆定體積絕熱火焰溫度 是
溫度 ,從一個完整的結果
燃燒 時發生,沒有任何處理的工作,
熱傳遞 或改變
動能 或
勢能 。它的溫度低於定容量過程,因為一些能量被用來改變系統的體積(即產生功)。
共同的火焰 在日常生活中,遇到的絕大多數火焰是有機化合物,包括
木材 ,
蠟 ,
脂肪 ,普通
塑膠 ,
丙烷 和
汽油 。這些物質在空氣中的恆壓絕熱火焰溫度在1950℃附近處於相對較窄的範圍內。這是因為,在以下方面的化學計量,有機化合物的與燃燒
n 碳涉及斷裂大致2
n C–H鍵,
n C–C鍵和1.5
n O
2 鍵以形成大致
n CO
2 分子和
n H
2 O分子。
由於大多數自然發生的燃燒過程發生在露天,所以沒有任何東西將氣體限制在發動機中的氣缸之類的特定容積內。結果,這些物質將在恆定的壓力下燃燒,使氣體在該過程中膨脹。
圖1 丙烷
常見的火焰溫度 假定初始大氣條件(1巴和20℃),下表列出了恆壓條件下各種氣體的絕熱火焰溫度。這裡所說的溫度是用於化學計量的燃料-氧化劑混合物(即
當量比 φ = 1)。
圖2 辛烷值 請注意,這些是火焰產生的理論而非實際的火焰溫度,不會產生熱量。最接近的將是火焰中最熱的部分,其中燃燒反應是最有效的。這也假定完全燃燒(例如完全平衡的,無煙的,通常是藍色的火焰)
普通燃料的絕熱火焰溫度(恆定壓力) 汽油 氧化劑 {\ displaystyle T_ {ad}}(C) {\ displaystyle T_ {ad}}(F) 2500
4532
3480
6296
空氣
1970年
3578
氧
4525
8177
氧
4990
9010
空氣
1955年
3551
空氣
2082
3779
空氣
2138
3880
空氣
2254
4089
氧
3200
5792
空氣
1982年
3600
空氣
1963年
3565
空氣
1949年
3540
空氣
1960年
3562
空氣
1977年
3591
空氣
1980年
3596
氧
2526
4579
空氣
2010
3650
氧
2927
5301
空氣
2071
3760
空氣
1980年
3596
空氣
2093
3801
輕油燃料
空氣
2104
3820
中等燃料油
空氣
2101
3815
重燃料油
空氣
2102
3817
空氣
2172
3943
空氣
2180
3957
氧
≈2900
≈5255
氧
3732
6750
氧
2438
4420
氧
2969
5376
氧
4005
7241
熱力學 從
熱力學 的第一定律來看,我們有一個封閉的反應系統,
圖3 封閉反應系統的熱力學第一定律 其中,
和
是分別在這個過程中從系統轉移到周圍環境的熱量和功
和
分別是反應物和產物的內能。在恆定絕熱火焰溫度的情況下,系統的體積保持不變,因此沒有工作發生,
並且沒有傳熱,因為該過程被定義為絕熱的:
。結果,產物的內能等於反應物的內能:
。因為這是一個封閉的體系,所以產品和反應物的質量是不變的,第一定律可以寫成大規模的,
圖4 內部能量與溫度關係圖說明封閉系統的計算 在恆壓絕熱火焰溫度的情況下,系統的壓力保持不變,導致下面的工作方程,
再次沒有傳熱發生,因為該過程被定義為絕熱的:
。從第一條法則來看,我們發現,
圖5 說明封閉系統計算的焓與溫度關係圖 回顧我們恢復的焓的定義:
。因為這是一個封閉的體系,所以產品和反應物的質量是不變的,第一定律可以寫成大規模的,
我們看到恆壓過程的絕熱火焰溫度低於恆定過程的絕熱火焰溫度。這是因為在燃燒過程中釋放的一些能量會改變控制系統的體積。通常在兩個過程之間進行的一個類比是通過在內燃機中燃燒。對於恆定體積絕熱過程,當活塞到達其頂點(Otto循環或恆定容積循環)時,燃燒被認為是瞬間發生的。對於恆壓絕熱過程,當發生燃燒時,活塞正在移動以保持壓力恆定(柴油循環或恆定壓力循環)。
如果我們假設燃燒完成(即,{\ displaystyle CO_ {2}}和{\ displaystyle H_ {2} O}),我們可以在
化學計量 條件下或者在稀化學計量(多餘空氣)下手工計算絕熱火焰溫度。這是因為有足夠的變數和摩爾方程來平衡左側和右側,
化學計量比較多,沒有足夠的變數,因為至少燃燒不能完成{\ displaystyle CO}和{\ displaystyle H_ {2}}需要的摩爾平衡(這些是最常見的不完全燃燒產物),
並使用這個反應的平衡常數,我們將有足夠的變數來完成計算。
具有不同能量和摩爾組分的不同燃料將具有不同的絕熱火焰溫度。
我們可以看到為什麼
硝基甲烷 (CH
3 NO
2 )經常被用作汽車的動力提升。由於每摩爾硝基甲烷含有兩摩爾氧氣,因此它可以燃燒得更熱,因為它提供了自己的氧化劑和燃料。這反過來又使其在恆定量的過程中產生更多的壓力。壓力越高,活塞上的力越大,在發動機中產生更多的功和更多的功率。值得注意的是,由於它含有自己的氧化劑,所以它保持比較熱的化學計量比。然而,由於這個較高的溫度,在硝基甲烷上連續運行發動機將最終熔化活塞和/或汽缸。
在現實世界的套用中,完全燃燒通常不會發生。化學規定
解離 和
動力學 會改變產物的相對組分。有許多方案可以計算絕熱火焰的溫度,考慮到通過平衡常數解析(Stanjan,NASA CEA,AFTP)。下圖說明了解離的影響會降低絕熱火焰的溫度。這個結果可以通過Le Chatelier的原理來解釋。
由於火焰溫度對化學反應速率所起到的作用,火焰溫度可能是燃燒最重要的一個性質。火焰溫度既可以通過實驗測量出來,又可以通過計算得到。為了方便起見,引入了
絕熱 火焰溫度的概念。絕熱火焰溫度指的是,在一定的初始溫度和壓力下,給定的燃料(包含燃料和氧化劑),在等壓絕熱條件下進行化學反應,燃燒系統(屬於封閉系統)所達到的終態溫度。在實際中,火焰的熱量有一部分以熱輻射和對流的方式損失掉了,所以絕熱火焰溫度基本上不可能達到。然而,絕熱火焰溫度在燃燒效率和熱量傳遞的計算中起到很重要的作用。對於高溫火焰(高於1800 K ),燃燒產物發生了分解反應,不但體積增大,還吸收了大量的熱量。在低溫時,化學當量比混合物或者貧燃料混合物燃燒後的產生應該只有CO2和H2O,然而這些產物很不穩定,只要溫度稍高一點,就可能部分轉變為成簡單的分子、原子和離子形式(例如,C0, H2, O, H和OH)。相應地在轉變過程中,能量被吸收,最大火焰溫度也相應地被減小了。
絕熱火焰溫度的影響因素很多,主要有空氣/燃料比、初始溫度和初始壓力。
 圖1 丙烷
圖1 丙烷 圖2 辛烷值
圖2 辛烷值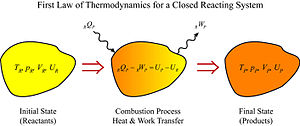 圖3 封閉反應系統的熱力學第一定律
圖3 封閉反應系統的熱力學第一定律

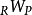





 圖4 內部能量與溫度關係圖說明封閉系統的計算
圖4 內部能量與溫度關係圖說明封閉系統的計算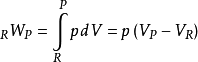


 圖5 說明封閉系統計算的焓與溫度關係圖
圖5 說明封閉系統計算的焓與溫度關係圖