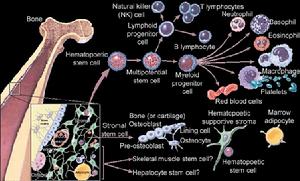
細胞分類
根據分化潛能及產生子細胞種類不同分類
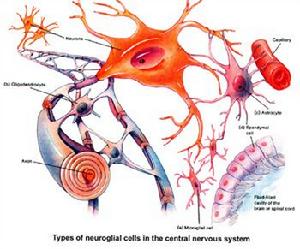
2)放射狀膠質神經元
可以分裂產生本身並同時產生神經元
前體細胞或是膠質細胞,主要作用是幼年時期神經發育過程中產生投射神經元完成大腦中皮質及
神經核等的基本神經組織細胞。
4)神經前體細胞
各類神經細胞的前體細胞,比如
小膠質細胞是由神經膠質細胞前體產生的。
根據部位分類
神經嵴幹細胞(neural crest stemcell,NC-SC)和中樞神經幹細胞(CNS-SC)。
外周神經幹細胞(PNS-SC),既可發育為外周神經細胞、
神經內分泌細胞和Schwann氏細胞,也能分化為
色素細胞(pigmented cell)和平滑肌細胞等。NSC一般是指存在於腦部的中樞神經幹細胞(CNS-SC),其
子代細胞能分化成為神經系統的大部分細胞。
以往認為,
中樞神經系統的
神經元在出生前或出生後不久,就失去
再生能力。但近年的一些研究表明,成年哺乳動物的腦組織仍可不斷產生新的神經元,成人腦組織中同樣存在NSC,主要是在
側腦室下層(SVZ)和海馬齒狀回兩處。
目前多使用
基因轉移的方法,建立神經幹細胞系,即誘導NSC的
細胞周期不斷循環往復,從而阻止其分化過程。
永生化的NSC具有較好的生物學特性,它們能
自我複製並在體外大量增殖,在移植人體內後仍具有多向分化潛能,同時可被
轉染並穩定地表達外源基因。
長期以來,人們一直認為成年哺乳動物腦內神經細胞不具備更新能力,一旦受損乃至死亡不能再生。這種觀點使人們對中樞神經系統疾病的治療受到了很大限制。雖然傳統的藥物、手術及康復治療取得了一定的進展,但是仍不能達到滿意的效果。
1992年,Reynolds等從成年小鼠腦
紋狀體中分離出能在體外不斷分裂增殖,且具有多種分化潛能的細胞群,並正式提出了神經幹細胞的概念,從而打破了認為神經細胞不能再生的傳統理論。Mckay於1997年在《
Science》雜誌上將神經幹細胞的概念總結為:具有分化為
神經元、
星形膠質細胞及
少突膠質細胞的能力,能自我更新並足以提供大量腦組織細胞的細胞。
細胞特點
自我更新
神經幹細胞具有對稱分裂及
不對稱分裂兩種分裂方式,從而保持幹細胞庫穩定。
 神經幹細胞
神經幹細胞多向分化
免疫源
神經幹細胞是未分化的原始細胞,不表達成熟的細胞抗原,不被免疫系統識別。
組織融合性
治療機理
1、患病部位組織損傷後釋放各種
趨化因子,可以吸引神經幹細胞聚集到損傷部位,並在局部
微環境的作用下分化為不同種類的細胞,修復及補充損傷的神經細胞。由於缺血、缺氧導致的血管
內皮細胞、
膠質細胞的損傷,使局部通透性增加,另外在多種
黏附分子的作用下,神經幹細胞可以透過
血腦屏障,高濃度的聚集在損傷部位;
2、神經幹細胞可以分泌多種
神經營養因子,促進損傷細胞的修復。
3、神經幹細胞可以增強
神經突觸之間的聯繫,建立新的神經環路。
細胞移植
傳統的藥物治療效果不令人滿意,吃藥只可暫時性的控制疾病,一旦停藥,病症復現甚至更嚴重。常年服藥不僅讓患者痛苦不已,而且對身體造成極大的危害,導致 其他嚴重疾病的並發。藥物不具備激活腦神經細胞的功能是根本原因,所以要想從根本上治療
腦病等神經系統疾病,藉助外界移植神經幹細胞是唯一有效的方法。
 神經幹細胞
神經幹細胞科學研究證明了神經幹細胞的定向分化性,使修復和替代死亡的神經細胞成為現實。為了減少
神經損傷的後遺症,延緩或抑止疾病的進一步發展,取得更好的恢復效果,從根本上修復和激活死亡神經細胞是十分必要的。
NSC是一群能自我更新並具有多種分化潛能的細胞,它來源於
神經組織並可生成神經組織,在適當條件下可分化成
神經元、
少突膠質細胞和星形細胞。以往的觀點認為,成年哺乳動物
CNS(中樞)的神經再生非常有限,而且隨著年齡的增長,神經元數量會逐漸減少。然而近20年的研究表明,成年哺乳動物CNS(
中樞神經系統)內仍然存在
神經發生。目前已明確的部位有海馬齒狀回、室管膜下區 [2,3] 。已有研究發現,在缺血缺氧條件下位於室管膜下區、海馬和脈絡膜叢等部位的內源性NSC可發生增殖、遷移並分化為神經元和
神經膠質細胞,因而提示中樞神經系統可通過自身內源性幹細胞來修復,只是由於條件不足而沒有足夠的新生細胞。最近的研究證實,這些原始NSC數量稀少,且處於靜止狀態,缺乏特異性形態、表面標誌和分化抗原,至今也不能高度純化分離,很難克隆化4]。因此,外源性NSC移植提供給我們一個大膽的新思路。許多研究表明,NSC移植物在
宿主CNS內具有明顯的生存、遷移和
分化能力,由人胎腦分離的NSC在植入
胚胎或新生鼠腦內後,表現為在宿主腦內遷移並進行區域特異性分化,若將相同的人胎腦NSC植入成年
大鼠室管膜下區,它們沿吻側遷移流遷移入
嗅球,分化為雙極
神經元,其分化命運與存留於室管膜下區的內源性NSC相同 [5]。從成年哺乳動物CNS分離的NSC也具有較強的分化潛能,而決定NSC分化命運的主要因素除局部
微環境外,還包括NSC的內在特性。如成年動物脊髓NSC植入
海馬齒狀回,能分化為神經元;若植入成年大鼠脊髓則不分化為神經元 [6] ;將從成年動物海馬齒狀回獲得的NSC植入成年
大鼠室管膜下區或遷移流後,能分化為
嗅球神經元;若植入成年大鼠
海馬,則產生新的海馬神經元 [7,8] 。無論
胚胎或成人NSC,在移植入成人
CNS非
神經發生區後大部分都分化成
神經膠質細胞。外源性CSN移植取得了令人鼓舞的成果。Modo等 [9] 給局灶性缺血大鼠移植MHP36鼠幹細胞,結果表明,移植的幹細胞可增殖分化成神經元細胞,並能顯著促進神經功能恢復;Zhang等 [10] 的研究發現,靜脈注射骨髓
間質細胞可進入腦梗死後的腦實質,並促進
新生血管形成。進一步的研究表明,移植的幹細胞和骨髓間質細胞可通過分泌
生長因子促進內源性神經元再生,促使神經功能恢復。
於炳新等 [11] 給局灶性腦缺血大鼠注射重組人
粒細胞集落刺激因子,動員自體骨髓
造血幹細胞。結果表明,腦實質內表達SYN和MAP-2蛋白的增殖細胞顯著增加,神經功能缺損明顯改善。因此認為,除通過骨髓間質細胞機制外,同時也可能存在
骨髓幹細胞腦實質內轉移,但尚待進一步的研究。
 神經幹細胞
神經幹細胞細胞套用
細胞因子與神經幹細胞的增殖、分化密切相關。不同的細胞因子在神經幹細胞的誘導分化中起重要作用,但尚沒有一種細胞因子能在體外將神經幹細胞全部誘導分化為所需的功能神經細胞,參與神經幹細胞誘導分化的細胞因子有
白細胞介素類,如IL-1、IL-7、IL-9及IL-11等。
神經營養因子對神經乾
細胞分化到終末細胞的整個過程均有影響,如果將培養的神經幹細胞置於
腦源性神經營養因子作用下,大量的神經幹細胞可以表現出分化
神經元的特性。
生長因子類,如
上皮生長因子、
神經生長因子及鹼性成
纖維細胞生長因子等也影響神經幹細胞的分化。神經幹細胞對不同種類、不同濃度的因子,以及多種因子聯合套用作用各不相同,在神經幹細胞發育分化的不同階段,相同因子的作用也不同。如在
表皮生長因子及鹼性成纖維細胞生長因子存在的條件下,
胚胎神經幹細胞主要向神經元、
星形膠質細胞和
少突膠質細胞分化,而出生後及成年的腦神經幹細胞,則無論是否有上皮生長因子及鹼性成纖維細胞生長因子,都主要分化為星形膠質細胞。這些研究提示,上皮生長因子及鹼性成纖維細胞生長因子對神經幹細胞向功能細胞的誘導分化是複雜的。
 神經幹細胞
神經幹細胞 信號轉導在神經乾
細胞分化中十分重要。作為一種信號傳導途徑,
Notch信號傳導系統尚未完全闡明。認為Notch受體是一種整合型膜蛋白,是一個保守的
細胞表面受體,它通過與周圍
配體接觸而被激活,其信號傳導途徑開始於Notch受體與配體結合後其
胞漿區從細胞膜上脫落,並向細胞核轉移,將信號傳遞給下游
信號分子。該途徑的信號傳遞主要是通過蛋白質相互作用,引起轉錄調節因子的改變或將轉錄調節因子結合到
靶基因上,實現對特定
基因轉錄的調控。當激活Notch途徑時,幹細胞進行增殖,當抑制Notch活性時,幹細胞進入分化程式。這些研究結果表明找到調節Notch信號途徑的方式,就可能通過改變
Notch信號來精確調控神經幹細胞向神經功能
細胞分化的過程和比例。此外,Janus激酶信號轉導
遞質與
轉錄激活劑(
JAK-STAT)
信號傳導系統也參與幹細胞的調控。
神經幹細胞的套用:神經幹細胞在神經發育和修復受損
神經組織中發揮重要作用。
神經幹細胞移植是修復和代替受損腦組織的有效方法,能重建部分環路和功能。此外神經幹細胞可作為
基因載體,用於
顱內腫瘤和其它神經疾病的
基因治療,利用神經幹細胞作為基因治療載體,彌補了病毒載體的一些不足。Wagner等將神經幹細胞移植到帕金森病模型的鼠腦,神經幹細胞在其腦組織中遷移並修復損毀的腦組織,且震顫症狀明顯減輕,可能是神經乾
細胞分化成為
多巴胺能
神經元起到治療作用。Piccini等從流產胎兒腦中分離的神經組織細胞,移植入患者的腦中治療
帕金森病,結果有一半以上的患者症狀得到明顯改善,而且效果持續存在。
多發性硬化是發病率較高的神經系統疾病,在其
嚙齒類動物模型中發現產生
髓鞘的
少突膠質細胞被破壞或失去功能,將神經幹細胞直接移植到鼠腦中,移植的細胞在腦中發生了大範圍的遷移,在分化成的少突膠質細胞中,約40%的細胞形成了髓鞘,其特性非常接近正常狀態,一些接受移植的動物其典型的症狀也得到了明顯的改善。
腦膠質瘤是醫學治療的難點之一,手術切除腫瘤困難,且容易復發,放療和
化療對腫瘤有一定的作用。由於神經幹細胞具有遷移的功能,利用這種特性可以向腦部釋放藥物。對鼠神經幹細胞進行轉基因處理,使之分泌
IL-4,這種物質能夠激活免疫系統,對腫瘤細胞發生抗瘤攻擊,患有腦膠質瘤的實驗鼠接受這種細胞注射之後,壽命比未治療的實驗鼠大大延長,
核磁共振成像表明,實驗鼠腦部的大塊腫瘤有縮小的跡象,有趣的是,即使注射的神經幹細胞不分泌IL-4,實驗鼠的壽命也會延長。Ling等認為這是由於神經幹細胞還能分泌一種能夠減緩腫瘤
細胞分裂的未知物質的緣故。此外,神經幹細胞對於判斷藥效及藥物
毒性等也有一定實用價值,如可以利用神經幹細胞培養技術觀察某些天然化合物和合成化合物的神經活性,為發展小分子治療藥物提供理論基礎。
神經幹細胞套用中存在的問題:建立的神經幹細胞系絕大多數來源於鼠,而鼠與人之間存在著明顯的種屬差異;神經幹細胞的來源不足;部分移植的神經幹細胞發展成
腦瘤;神經幹細胞
轉染範圍的非選擇性表達及轉染
基因表達的原位調節;利用
胚胎幹細胞代替神經幹細胞存在著社會學及倫理學方面的問題等。(神經幹細胞系的建立可以無限地提供
神經元和
膠質細胞,解決了胎
腦移植數量不足的問題,同時避免了倫理學方面的爭論,為損傷後進行代替治療提供了充足的
種子細胞)。
 神經幹細胞
神經幹細胞神經幹細胞的來源、分離、培養及鑑定還有許多工作要做,神經幹細胞誘導、分化及遷移機制有待進一步研究。通過
細胞培養技術及
基因組的研究,如DNA微列陣技術,進一步明確成體神經幹細胞的確切位置,可以設計藥物特異性地激活這些細胞。進一步認識神經幹細胞的本質和控制分化基因,通過調控
靶基因,可以從神經幹細胞誘導產生特定的分化細胞來滿足各種需要。橫向分化的發現對神經幹細胞的研究和套用具有重要意義,人們可望從自體中分離誘導出神經幹細胞,有可能解決神經幹細胞的來源問題,神經幹細胞的套用將有廣闊的前景。
 神經幹細胞
神經幹細胞 神經幹細胞
神經幹細胞 神經幹細胞
神經幹細胞 神經幹細胞
神經幹細胞
 神經幹細胞
神經幹細胞 神經幹細胞
神經幹細胞 神經幹細胞
神經幹細胞 神經幹細胞
神經幹細胞