物質概況
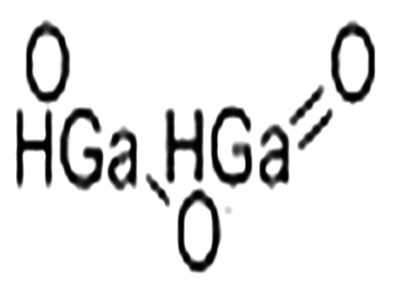 氧化鎵結構式
氧化鎵結構式中文同義詞:三氧化二鎵;氧化鎵(Ⅲ);氧化鎵, 99.999% (METALS BASIS);氧化鎵, PURATRONIC|R, 99.999% (METALS BASIS);氧化鎵, 99.995% (METALS BASIS);氧化鎵, 99.99% (METALS BASIS);氧化鎵 (METALS BASIS);
英文同義詞:GALLIUM SESQUIOXIDE;GALLIUM OXIDE;GALLIUM(III) OXIDE;GALLIUM(+3)OXIDE;Digallium trioxide;digalliumtrioxide;Ga2-O3;Gallia;
相關類別:鎵金屬和陶瓷科學;氧化物;催化和無機化學;化學合成;鎵;金屬氧化物;
Mol檔案:12024-21-4.mol
同分異構體
氧化鎵(III),即三氧化二鎵,是鎵的氧化物中最穩定的。在空氣中加熱
金屬鎵使之氧化,或在200-250℃時
焙燒硝酸鎵、
氫氧化鎵以及某些鎵的化合物都可形成Ga
2O
3。
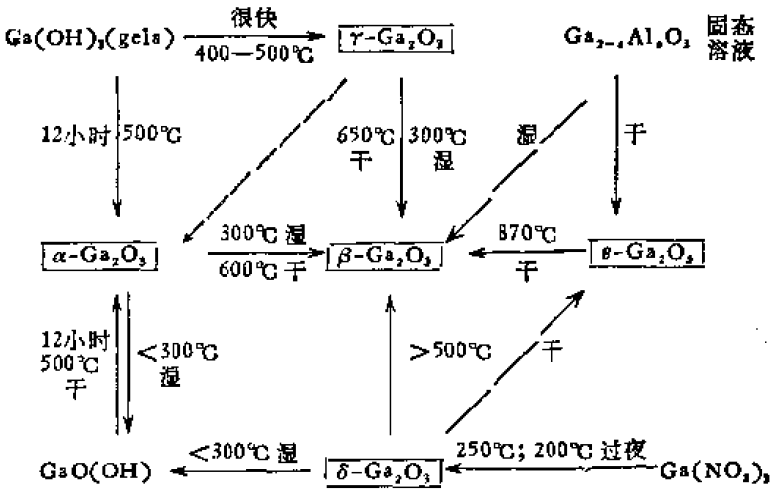 氫氧化鎵的轉換和脫水
氫氧化鎵的轉換和脫水Ga
2O
3 有五種
同分異構體:α,β,γ,δ,ε,其中最穩定的是β-異構體,當加熱至1000℃以上或水熱條件(即
濕法)加熱至300℃以上時,所有其他的異構體都被轉換為β-異構體。可採用各自不同的方法製得各種純的異構體。
把
金屬鎵在空氣中加熱至420~440℃;焙燒
硝酸鹽使之分解或加熱氫氧化鎵至500℃等都可製得α-Ga
2O
3。
快速加熱
氫氧化物凝膠至400~500℃可值得γ-Ga
2O
3,γ-Ga
2O
3具有缺陷的
尖晶石結構。
在250℃加熱硝酸鎵然後在約200℃浸潰12小時,可製得δ-Ga2O3,它類似於In2O3、Tl2O3、Mn2O3和Ln2O3的C-結構。
在550℃短暫加熱(約30分鐘)δ-Ga2O3可製得ε-Ga2O3。
將硝酸鹽、
醋酸鹽、
草酸鹽或其他鎵的化合物以及Ga
2O
3的任意其他異構體加熱至1000℃以上均可分解或轉化為β-Ga
2O
3。
物理性質
白色三角形的結晶顆粒。不溶於水。
微溶於熱酸或鹼溶液。熔點1900℃(在600℃時轉化為β型)。
有α,β兩種變體。α型為白色菱形六面體。
物性數據:
性狀:α-Ga
2O
3為
六方晶型,β-Ga
2O
3屬於單斜晶型。
熔點(ºC):1740
化學性質
Ga
2O
3能與
氟氣反應,生成GaF
3,Ga
2O
3溶於50%的HF中得到產物GaF
3·3H
2O。Ga
2O
3能溶於微熱的
稀硝酸、稀鹽酸和
稀硫酸中。經過灼燒的Ga
2O
3不溶於這些酸甚至於
濃硝酸,也不溶於
強鹼的
水溶液中,只能通過
NaOH、KOH或KHSO4和K
2S
2O
7一起
熔融才能使它溶解。與過量兩倍的NH
4Cl在250℃一起熔融生成
氯化鎵。在紅熱時,Ga
2O
3與
石英反應形成
玻璃體,但冷卻時沒有新化合物生成。紅熱時也能和上釉的
瓷坩堝發生反應。
在加熱的條件下,Ga
2O
3能與許多
金屬氧化物發生反應。現已測定了
鹼金屬氧化物反應(高於400℃)所得到的鎵酸鹽M(I)GaO
2的
晶體結構,與Al
2O
3和Ln
2O
3一樣,它與MgO、ZnO、CoO、NiO和CuO反應能形成
尖晶石型的M(II)Ga
2O
4。與三價金屬氧化物反應的產物M(III)GaO
3通常有
鈣鈦礦或
石榴石型結構(如鑭系鎵酸鹽LnGaO
3)。而且有更為複雜的三元氧化物。人們研究過有關用於雷射、
磷光和
發光材料的鎵的混合氧化物。認為鎵酸鹽的發光性質歸之於氧的空缺。因為FeGaO
3有令人感興趣的電磁性質(即
壓電性和
鐵磁性),所以它的合成、穩定性和晶體結構已被人們廣泛地研究。
Ga
2-xFe
xO
3(x≈1)屬於正交晶體,
晶胞參數是:
a=8.75A,
b=9.40A,
c=5.07A,
配位數為8,
熔融溫度是1750℃,密度是5.53g/cm
3。NiO·Fe
2-xGa
xO
3的磁性和
晶體結構也被研究過。
生態數據
通常對水體是稍微有害的,不要將未稀釋或大量產品接觸地下水,水道或污水系統,未經政府許可勿將材料排入周圍環境。
化學數據
2、氫鍵受體數量:3
3、可旋轉化學鍵數量:0
5、重原子數量:5
6、表面電荷:0
7、複雜度:34.2
9、確定原子立構中心數量: 0
10、不確定原子立構中心數量:0
11、確定化學鍵立構中心數量:0
12、不確定化學鍵立構中心數量:0
製備
1.向三
氯化鎵GaCl
3的熱水溶液中加NaHCO
3的高濃熱水溶液,煮沸到鎵的
氫氧化物全部沉澱出來為止。用熱水洗滌沉澱至沒有Cl
-為止,在600℃以上煅燒則得到β-Ga
2O
3。殘留NH
4Cl時,在250℃就和Ga
2O
3反應,生成揮發性GaCl
3。
2.這是高純Ga
2O
3的製法。以高純金屬Ga為陽極,溶解於5%~20%H
2SO
4溶液里,向溶液加
氨水,冷卻,將Ga(NH
4)(SO
4)
2反覆結晶,在105℃乾燥,在過量氧的條件下在800℃灼燒2h,則得到純度為99.99%~99.9999%的產品。
3.稱取1kg99.9999%的
高純鎵放入三頸
燒瓶中,加入高純
硝酸,使鎵全部溶解,然後過濾,濾液倒入三頸燒瓶中,移至電爐上蒸發(在
通風櫥中進行),濃縮到接近結晶時,將溶液移置於大號
蒸發皿中蒸發至乾。將蒸乾的Ga(NO
3)
3放在
馬弗爐中進行灼燒,溫度控制在550℃,灼燒5h,待冷卻後取出成品,得1.2kg高純氧化鎵。
氧化鎵納米棒
引言
具有固定的尺寸和形狀的一維半導體納米結構如納米線,納米棒,納米管等,由於具有獨特的結構、光學和電學等特性,在光學催化、鋰離子電池、紫外探測器和氣體感測器等方面具有廣泛的套用。β-Ga2O3是一種禁頻寬度在4.7-4.9eV的寬禁帶半導體氧化物,具有良好的熱穩定性和化學穩定性,在大功率,高電壓和高電流密度的設備上具有良好的套用前景。此外還具有導電和發光特性,在高溫氣體感測器和透明導電光電器件上套用廣泛。一維半導體納米結構材料由於具有新奇的特性在納米器件中具有潛在的套用價值,因此一維氧化鎵納米材料的製備及其結構表征受到人們的極大關注。
一維 β-Ga2O3納米結構(納米線,納米片,納米棒等)已被大量合成,製備的方法有熱蒸發,雷射燒蝕法,金屬有機化學氣相沉積法和水熱法等。目前一維氧化鎵納米材料的生長主要遵循 VLS和VS生長機制,另外Au 或者Pt 等催化劑也被成功用於促進納米材料的生長。
以簡單的碳熱還原法成功製備出了 Ga2O3納米棒,這種納米棒狀結構在積體電路中可能具有潛在的套用。
實驗
氧化鎵納米結構的合成是在管式高溫擴散爐中進行.首先是將矽片(基底)鍍金,鍍金之前先將矽片依次用丙酮、乙醇和去離子水進行超聲水洗,然後放置在烘箱中烘乾,最後利用磁控濺射儀濺射沉積厚度約為20nm的金薄膜即可.實驗原材料是氧化鎵粉末,和碳粉按照 1:2的質量比混合,放置在石英舟中,在距混合粉末1.5cm左右處擺放鍍金的矽片,根據氮氣流的方向,以混合粉末在石英舟上游,矽片在下游的順序將石英舟緩慢推進高溫擴散爐的的石英管的中心.設定加熱程式,將擴散爐加熱到1300℃並保溫60min,然後取出自然冷卻到室溫,可以看到矽片上有大量的白色絮狀物。最後將所得的樣品用SEM、TEM、XRD 等進行表征。
通過以上檢測結果分析,可以確定所製備的樣品為β-Ga2O3納米棒,其生長遵循VLS 生長機制:在1300℃ 的高溫下,基底中的 Si 原子與基底上的Au 原子熔融形成Si-Au合金液滴。Ga2O3粉末與碳粉發生碳熱還原反應生成Ga2O蒸汽,隨著 N2輸送並沉積到基底表面,此時基底表面的合金液滴開始不斷的吸收Ga2O,當合金液滴達到飽和狀態便會析出Ga2O,隨著反應的不斷進行,飽和的合金液滴不斷的析出Ga2O,在頂部牽引著 Ga2O 納米結構的生長。當反應一段時間取出石英舟時,Ga2O迅速被空氣中的O2氧化生成 Ga2O3,形成 Ga2O3納米結構。
套用
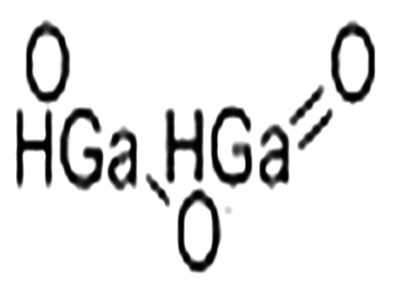 氧化鎵結構式
氧化鎵結構式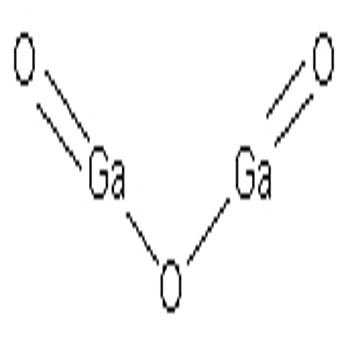
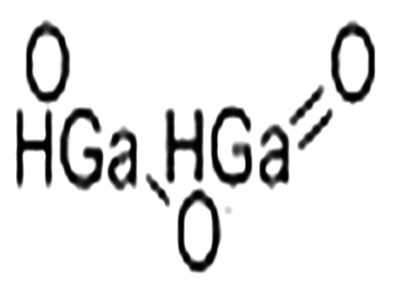 氧化鎵結構式
氧化鎵結構式