比熱容(Specific Heat Capacity,符號
c),簡稱
比熱,亦稱
比熱容量,是
熱力學中常用的一個物理量,表示物體吸熱或散熱能力。比熱容越大,物體的吸熱或散熱能力越強。它指
單位質量的某種
物質升高或下降單位
溫度所吸收或放出的
熱量。其國際單位制中的單位是
焦耳每
千克開爾文[J/( kg· K )],即令1KG的物質的溫度上升1開爾文所需的能量。根據此定理,最基本便可得出以下公式:
物質的比熱容越大,相同質量和溫升時,需要更多
熱能。以
水和
油為例,
水和
油的比熱容分別約為4200 J/(kg·K)和2000 J/(kg·K),即把相同質量的
水加熱的
熱能比
油多出約一倍。若以相同的
熱能分別把相同質量的
水和
油加熱的話,
油的溫升將比
水的溫升大。
卡諾定理指出,
可逆循環的
效率只與高溫熱源和低溫熱源的溫度有關,而與工作物質(工質)或工作路徑等其它因素無關
熱力學溫度又被稱為
絕對溫度,是
熱力學和統計物理中的重要參數之一。一般所說的
絕對零度便是對應-273.15攝氏度。
學科定義
一定質量的物質,在溫度升高時,所吸收的熱量與該物質的質量和升高的溫度乘積之比,稱做這種物質的比熱容(比熱),用符號c表示。其
國際單位制中的單位是
焦耳每
千克開爾文[J /(kg·K) ]或焦耳每千克每攝氏度[J /(kg·℃)]。J是指焦耳,K是指
熱力學溫標,即令1千克的物質的溫度上升(或下降)1開爾文所需的能量。根據此定理,便可得出以下公式:
Q為吸收(或放出)的熱量;m是物體的質量,ΔT是吸熱(或放熱)後溫度的變化量,國中的教材里把ΔT寫成Δt,其實這是不
規範的(我們生活中常用℃作為溫度的單位,很少用K,而且ΔT=Δt,因此中學階段都用Δt,但國際或更高等的科學領域仍用ΔT)。
物質的比熱容與所進行的過程有關。在工程套用上常用的有
定壓比熱容Cp、
定容比熱容Cv和飽和狀態比熱容三種。
定壓比熱容Cp:是單位質量的物質在
壓力不變的條件下,溫度升高或下降1℃或1K所吸收或放出的能量。
定容比熱容Cv:是單位質量的物質在容積(體積)不變的條件下,溫度升高或下降1℃或1K吸收或放出的能量。
飽和狀態比熱容:是單位質量的物質在某飽和狀態時,溫度升高或下降1℃或1K所吸收或放出的熱量。
單位
比熱容的單位是複合單位。
在
國際單位制中,能量、
功、熱量的主單位統一為
焦耳,溫度的主單位是
開爾文,因此比熱容的國際單位為
J/(kg·K),讀作“焦[耳]每
千克開[爾文]”。國際單位或為
J/(kg·℃),讀作“焦[耳]每千克攝氏度([]內的字可以省略。)
常用單位:J/(kg·℃)、J/(g·℃)、kJ/(kg·℃)、cal/(kg·℃)、kcal/(kg·℃)等。注意攝氏度和開爾文僅在溫標表示上有所區別,在表示溫差的量值意義上等價,因此這些單位中的℃和K可以任意互相替換。例如“
焦每千克攝氏度”和“
焦每千克開”是等價的。
計算
設有一質量為m的物體,在某一過程中吸收(或放出)熱量ΔQ時,溫度升高(或降低)ΔT,則ΔQ/ΔT稱為物體在此過程中的
熱容量(簡稱熱容),用C表示,即C=ΔQ/ΔT。用熱容除以質量,即得比熱容c=C/m=ΔQ/mΔT。對於微小過程的熱容和比熱容,分別有C=dQ/dT,c=1/m*dQ/dT。因此,在物體溫度由T1變化到T2的有限過程中,吸收(或放出)的熱量Q=∫(T2,T1)CdT=m∫(T2,T1)cdT。
一般情況下,熱容與比熱容均為溫度的函式,但在溫度變化範圍不太大時,可近似地看為
常量。於是有Q=C(T2-T1)=mc(T2-T1)。如令溫度改變數ΔT=T2-T1,則有Q=cmΔT。這是中學中用比熱容來計算熱量的基本公式。
在英文中,比熱容被稱為:Specific Heat Capacity(SHC)。
用比熱容計算熱能的公式為:能量=質量×比熱×溫度變化
可簡寫為:Energy=SHC×Mass×Temp Ch,
與比熱相關的熱量計算公式:Q=cmΔT 即Q吸(放)=cm(T初-T末) 其中c為比熱,m為質量,Q為能量熱量。吸熱時為Q=cmΔT升(用實際升高溫度減物體初溫),放熱時為Q=cmΔT降(用實際初溫減降後溫度)。或者Q=cmΔT=cm(T末-T初),Q>0時為吸熱,Q<0時為放熱。
Q吸=cm(t-to)Q放=cm(to-t)
c表示比熱容.
m表示物體的質量
to表示物體的初溫
t表示物體的末溫
(△t:物體變化溫度,即t-t0)
這是用來計算物體溫度升高時的公式。若物體降低時,則是用物體的初溫度減去末溫度。即。
液態水數據
在實驗過程中,液態水的定壓比熱容經常會被用來計算吸收或放出的熱量,水作為最常見的物質,它的比熱數據較易獲得,當實驗要求精度不高時,可近似認為常壓下水的定壓比熱為4.2kJ/KG.℃,
下面給出在不同壓力,不同溫度下的液態水的定壓比熱容Cp的數據 (單位:KJ/(KG.℃))
壓力
x10^5 Pa | 溫度(攝氏度) |
0 | 20 | 50 | 100 | 150 | 200 | 250 | 300 | 350 |
1 | 4.217 | 4.182 | 4.181 | | | | | | |
5 | 4.215 | 4.181 | 4.180 | 4.215 | 4.310 | | | | |
10 | 4.212 | 4.179 | 4.179 | 4.214 | 4.308 | | | | |
50 | 4.191 | 4.166 | 4.170 | 4.205 | 4.296 | 4.477 | 4.855 | 3.299 | |
100 | 4.165 | 4.151 | 4.158 | 4.194 | 4.281 | 4.450 | 4.791 | 5.703 | 4.042 |
150 | 4.141 | 4.137 | 4.148 | 4.183 | 4.266 | 4.425 | 4.735 | 5.495 | 8.863 |
200 | 4.117 | 4.123 | 4.137 | 4.173 | 4.252 | 4.402 | 4.685 | 5.332 | 8.103 |
250 | 4.095 | 4.109 | 4.127 | 4.163 | 4.239 | 4.379 | 4.639 | 5.201 | 7.017 |
300 | 4.073 | 4.097 | 4.117 | 4.153 | 4.226 | 4.358 | 4.598 | 5.091 | 6.451 |
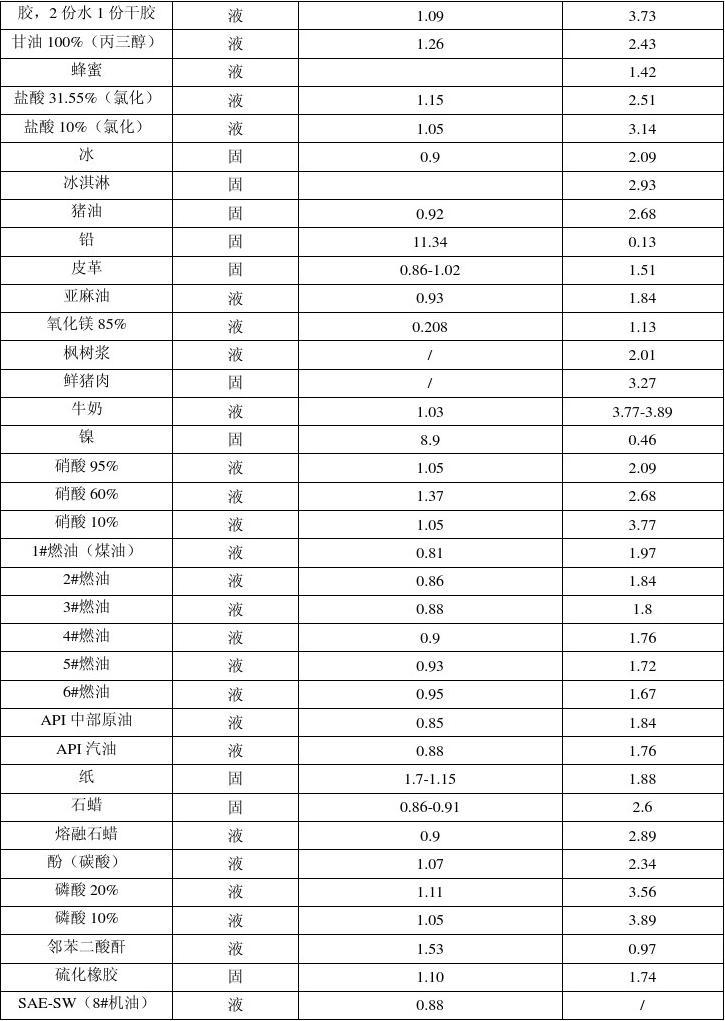
物質
單位質量的某種物質,溫度降低1度放出的熱量,與它溫度升高一度吸收的熱量相等,數值上也等於它的比熱容。
| 物質 | 化學符號 | 模型 | 狀態 | 比熱容量(基本) J/(kg·℃) | 比熱容量(25℃)J/(kg·K) |
|---|
| H | 2 | 氣 | 14000 | 14300 |
| He | 1 | 氣 | 5190 | 5193.2 |
| NH3 | 4 | 氣 | 2055 | 2050 |
| Ne | 1 | 氣 | 1030 | 1030.1 |
| Li | 1 | 固 | 3580 | 3582 |
乙醇 | C2H5OH | 9 | 液 | 2460 | 2440 |
汽油 | 混 | 混 | 液 | 2200 | 2220 |
| CnH2n+2 | 62至122 | 固 | 2200 | 2500 |
甲烷 | CH4 | 5 | 氣 | 2160 | 2156 |
油 | 混 | 混 | 液 | 2000 | 2000 |
| 混 | 混 | 固 | 2000 | 2000 |
| C2H6 | 8 | 氣 | 1730 | 1729 |
| 混 | 混 | 固 | 1700 | 1720 |
| C2H2 | 4 | 氣 | 1500 | 1511 |
| CH2 | 3 | 固 | 1300 | 1300 |
| H2S | 3 | 氣 | 1100 | 1105 |
氮 | N | 2 | 氣 | 1040 | 1042 |
空氣(室溫) | 混 | 混 | 氣 | 1030 | 1012 |
空氣(海平面、乾燥、0℃) | 混 | 混 | 氣 | 1005 | 1035 |
| O | 2 | 氣 | 920 | 918 |
二氧化碳 | CO2 | 3 | 氣 | 840 | 839 |
一氧化碳 | CO | 2 | 氣 | 1040 | 1042 |
| Al | 1 | 固 | 900 | 897 |
| 混 | 混 | 固 | 840 | 847 |
陶瓷 | 混 | 混 | 固 | 840 | 837 |
| F | 2 | 氣 | 820 | 823.9 |
磚 | 混 | 混 | 固 | 750 | 750 |
石墨 | C | 1 | 固 | 720 | 710 |
| CF4 | 5 | 氣 | 660 | 659.1 |
二氧化硫 | SO2 | 3 | 氣 | 600 | 620 |
| 混 | 混 | 固 | 600 | 840 |
| Cl2 | 2 | 氣 | 520 | 520 |
鑽石 | C | 1 | 固 | 502 | 509.1 |
鋼 | 混 | 混 | 固 | 460 | 450 |
| Fe | 1 | 固 | 460 | 444 |
| Cu,Zn | 混 | 固 | 380 | 377 |
銅 | Cu | 1 | 固 | 385 | 386 |
銀 | Ag | 1 | 固 | 235 | 233 |
汞 | Hg | 1 | 液 | 139 | 140 |
| Pt | 1 | 固 | 135 | 135 |
金 | Au | 1 | 固 | 129 | 126 |
鉛 | Pb | 1 | 固 | 125 | 128 |
| H2O | 3 | 氣 | 1850 | 1850 |
| H2O | 3 | 液 | 4200 | 4186 |
| H2O | 3 | 固 | 2100 | 2050 (-10℃) |
理論上說,常見液體和固體物質中,水的比熱容最大
對上表中數值的解釋:
⑴比熱此表中單位為 kj/(kg·℃)/ j/(kg·℃),兩單位為千進制1kJ/(kg·℃)/=1×103J/(kg·℃)
⑵水的比熱較大,金屬的比熱更小一些
⑶c鋁>c鋼>c鐵>c鉛 (c鉛<c鐵<c鋼<c鋁)。
補充說明:
⒈不同的物質有不同的比熱容,比熱容是物質的一種特性,因此,可以用比熱的不同來(粗略地)鑑別不同的物質(注意有部分物質比熱相當接近)。
⒉同一物質的比熱一般不隨質量、形狀的變化而變化。如一杯水與一桶水,它們的比熱相同,即比熱容為廣延性質。
⒊
對同一物質,比熱值與物態有關,同一物質在同一
狀態下的比熱是一定的(忽略溫度對比熱的影響),但在不同的狀態時,比熱是不相同的。例如水的比熱與凍的
比熱不同。
⒋在溫度改變時,比熱容也有很小的變化,但一般情況下可以忽略。比熱容表中所給的比熱數值是這些物質在常溫下的平均值。
⒌氣體的比熱容和氣體的熱膨脹有密切關係,在體積恆定與壓強恆定時不同,故有
定容比熱容和
定壓比熱容兩個概念。但對固體和液體,二者差別很小,一般就不再加以區分。
常見氣體的比熱容
(單位:kJ/(kg·K))
Cp Cv
氫氣14.05 9.934
套用
水的比熱容較大,在工農業生產和日常生活中有廣泛的套用。這個套用主要考慮兩個方面,第一是一定質量的水吸收(或放出)很多的熱而自身的溫度卻變化不大,有利於調節氣候;第二是一定質量的水升高(或降低)一定溫度吸熱(或放熱)很多,有利於用水作冷卻劑或取暖。
調節氣候
水的比熱容較大,對於氣候的變化有顯著的影響。在同樣受熱或冷卻的情況下,水的溫度變化較小,水的這個特徵對氣候影響很大,白天沿海地區比內陸地區溫升慢,夜晚沿海溫度降低少,為此一天中沿海地區溫度變化小,內陸溫度變化大,一年之中夏季內陸比沿海炎熱,冬季內陸比沿海寒冷。當環境溫度變化較快的時候,水的溫度變化相對較慢。生物體內水的比例很高,有助於調節生物體自身的溫度,以免溫度變化太快對生物體造成嚴重損害。
海陸風的形成原因與之類似。
1.對氣溫的影響
據新華社訊息,
三峽水庫蓄水後,這個世界上最大的人工湖將成為一個天然“空調”,使山城重慶的氣候冬暖夏涼。據估計,夏天氣溫可能會因此下降5℃,冬天氣溫可能會上升3到4℃。
晴朗無風的夏日,海島上的地面氣溫,高於周圍海上氣溫,並因此形成海風環流以及海島上空的積雲對流,這是海洋熱島效應的表現。水的比熱容是沙石的4倍多。質量相同的水和沙石,要使它們上升同樣的溫度,水會吸收更多的熱量;如果吸收或放出的熱量相同,水的溫度變化比沙石小得多。夏天,陽光照在海上,儘管海水吸收了許多熱量,但是由於它的比熱容較大,所以海水的溫度變化並不大,海邊的氣溫變化也不會很大。而在沙漠,由於沙石的比熱容較小,吸收同樣的熱量,溫度會上升很多,所以沙漠的晝夜溫差很大。海岸晝夜溫差變化比沙漠中小,適於居住。2010~2013年以來,由於城市人口集中,工業發達,交通擁塞,大氣污染嚴重,且城市中的建築大多為石頭和
混凝土建成,在溫度的空間分布上, 城市猶如一個溫暖的島嶼,從而形成
城市熱島效應。在緩解熱島效應方面,專家測算,一個中型城市環城綠化帶樹苗長成濃蔭後,綠化帶常年涵養水源相當於一座容積為1.14×10m
3的中型水庫,由於水的比熱容大,能使城區夏季高溫下降1℃以上,有效緩解日益嚴重的“熱島效應”。
水庫的建立,水的增加,而水的比熱容大,在同樣受冷受熱時溫度變化較小,從而使夏天的溫度不會升得比過去高,冬天的溫度不會下降得比過去低,使溫度保持相對穩定,從而水庫成為一個巨大的“天然空調”。
冷卻或取暖
1.水冷系統的套用
人們很早就開始用水來冷卻發熱的機器,在電腦
CPU散熱中可以利用散熱片與CPU核心接觸,使CPU產生的熱量通過
熱傳導的方式傳輸到散熱片上,然後利用風扇將散發到空氣中的熱量帶走。但水的比熱容遠遠大於空氣,因此可以用水代替空氣作為散熱介質,通過水泵將內能增加的水帶走,組成水冷系統。這樣CPU產生的熱量傳輸到水中後水的溫度不會明顯上升,散熱性能優於上述直接利用空氣和風扇的系統。
武器:第一次世界大戰和第二次世界大戰當中,一些武器使用的是水冷式槍管;一些戰鬥機和轟炸機的引擎使用的是水冷式引擎。
熱機(例如汽車的發動機,發電廠的發電機等)的冷卻系統也用和水做為冷卻液,也是利用了水的比熱容大這一特性。
2.農業生產上的套用
水稻是喜溫作物,在每年三四月份育苗的時候,為了防止霜凍,農民普遍採用“淺水勤灌”的方法,即傍晚在秧田裡灌一些水過夜,第二天太陽升起的時候,再把秧田中的水放掉。根據水的比熱容大的特性,在夜晚降溫時,使秧苗的溫度變化不大,對秧苗起了保溫作用。
3.熱水取暖
冬季供熱用的散熱器、暖水袋。我國北方樓房中的“暖氣”用水作為介質,把燃料燃燒時產生的熱量帶到房屋中取暖。
4.其他
諸如在炎熱的夏天古代皇室用流水從屋頂上流下,起了防暑降溫作用;夏威夷是太平洋深處的一個島,那裡氣候宜人,是旅遊度假的聖地,除了景色誘人之外,還有一個主要原因就是冬暖夏涼。
歷史
最初是在
18世紀,蘇格蘭的物理學家兼化學家J.布萊克發現質量相同的不同物質,上升到相同溫度所需的熱量不同,而提出了比熱容的概念。幾乎任何物質皆可測量比熱容,如化學元素、化合物、合金、溶液,以及
複合材料。
歷史上,曾以
水的比熱容來定義熱量,將1克水升高1度所需的熱量定義為1
卡路里。