物質解析
分類介體
向
微生物燃料電池中添加的介體主要有兩種:第一類是人工合成的介體,主要是一些染料類的物質,如
吩嗪、吩噻嗪、
靛酚、
硫堇等等。這些介體必須滿足一定的條件:
(2) 非常容易得電子;(3) 在被還原之前能快速離開
微生物細胞;

(5) 穩定性好;
(8) 不會被
微生物代謝掉。第二類是某些
微生物自身可以合成
介體,如
Pseudomonas aeruginosastrainKRP1能夠合成綠膿菌素和吩嗪-1-甲醯胺等物質,它合成的介體不光自己可以使用,其它的微生物也可以利用它產生的介體傳遞電子。
作用原理
參與傳遞電子的介體與
微生物和
陽極之間的作用形式有三種:(1) 微生物將氧化還原反應產生的電子直接傳遞給溶解在溶液中的介體,介體再將
電子傳遞給
電極;(2)介體能進入到微生物體內,參加反應被還原,從微生物體內出來後再將電子傳遞給電極;(3) 微生物吸附在電極表面,它將反應產生的電子傳遞給在
細胞表面的介體,再通過介體傳遞給電極。
優勢
與現有的其它利用有機物產能的技術相比,
微生物燃料電池具有操作上和功能上的優勢: 首先,它將
底物直接轉化為
電能,保證了具有高的
能量轉化效率; 其次,不同於現有的所有生物能處理,微生物燃料電池在常溫環境條件下能夠有效運作; 第三,微生物燃料電池不需要進行廢氣處理,因為它所產生的廢氣的主要組分是
二氧化碳,
一般條件下不具有可再利用的
能量; 第四,微生物燃料電池不需要輸入較大能量,因為若是單室微生物燃料電池僅需通風就可以被動的補充
陰極氣體; 第五,在缺乏電力基礎設施的局部地區,微生物燃料電池具有廣泛套用的潛力,同時也擴大了用來滿足我們對能源需求的燃料的多樣性。
生物技術
作用原理
微生物
燃料電池(MFCs)提供了從可
生物降解的、還原的
化合物中維持能量產生的新機會。MFCs可以利用不同的
碳水化合物,同時也可以利用廢水中含有的各種複雜物質。關於它所涉及的
能量代謝過程,以及
細菌利用
陽極作為
電子受體的本質,目前都只有極其有限的信息;還沒有建立關於其中
電子傳遞機制的清晰理論。倘若要最佳化並完整的發展MFCs的產能理論,這些知識都是必須的。依據MFC工作的參數,
細菌使用著不同的代謝通路。這也決定了如何選擇特定的
微生物及其對應的不同的性能。在此,我們將討論
細菌是如何使用
陽極作為
電子傳遞的受體,以及它們產能輸出的能力。對MFC技術的評價是在與目前其它的產能途徑比較下作出的。
微生物燃料電池並不是新興的東西,利用微生物作為電池中的
催化劑這一概念從上個世紀70年代就已存在,並且使用微生物燃料電池處理家庭污水的構想也於1991年實現。但是,經過提升
能量輸出的微生物
燃料電池則是新生的,為這一事物的實際套用提供了可能的機會。
MFCs將可以被
生物降解的物質中可利用的
能量直接轉化成為
電能。要達到這一目的,只需要使
細菌從利用它的天然
電子傳遞受體,例如
氧或者
氮,轉化為利用不溶性的受體,比如MFC的
陽極。這一轉換可以通過使用膜聯組分或者可溶性電子穿梭體來實現。然後電子經由一個
電阻器流向
陰極,在那裡
電子受體被還原。與厭氧性消化作用相比,MFC能產生電流,並且生成了以
二氧化碳為主的廢氣。
與現有的其它利用有機物產能的技術相比,MFCs具有操作上和功能上的優勢。首先它將
底物直接轉化為
電能,保證了具有高的
能量轉化效率。其次,不同於現有的所有生物能處理,MFCs在
常溫,甚至是低溫的環境條件下都能夠有效運作。第三,MFC不需要進行廢氣處理,因為它所產生的廢氣的主要組分是
二氧化碳,一般條件下不具有可再利用的能量。第四,MFCs不需要
能量輸入,因為僅需通風就可以被動的補充陰極氣體。第五,在缺乏電力基礎設施的局部地區,MFCs具有廣泛套用的潛力,同時也擴大了用來滿足我們對能源需求的燃料的多樣性。
微生物燃料電池中的代謝
在高
陽極電勢的情況下,
細菌在氧化代謝時能夠使用
呼吸鏈。電子及其相伴隨的質子傳遞需要通過NADH
脫氫酶、
泛醌、
輔酶Q或
細胞色素。Kim等研究了這條通路的利用情況。他們觀察到MFC中電流的產生能夠被多種電子呼吸鏈的抑制劑所阻斷。在他們所使用的MFC中,
電子傳遞系統利用NADH脫氫酶,Fe/S(鐵/硫)蛋白以及醌作為
電子載體,而不使用
電子傳遞鏈的2號位點或者
末端氧化酶。通常觀察到,在MFCs的傳遞過程中需要利用氧化磷酸化作用,導致其
能量轉化效率高達65%。常見的實例包括假單胞菌(Pseudomonas aeruginosa),微
腸球菌(Enterococcus faecium)以及Rhodoferax ferrireducens。
如果存在其它可替代的
電子受體,如
硫酸鹽,會導致
陽極電勢降低,電子則易於沉積在這些組分上。當使用厭氧淤泥作為
接種體時,可以重複性的觀察到沼氣的產生,提示在這種情況下
細菌並未使用
陽極。如果沒有
硫酸鹽、硝酸鹽或者其它電子受體的存在,如果
陽極持續維持低電勢則
發酵就成為此時的主要代謝過程。例如,在
葡萄糖的
發酵過程中,涉及到的可能的反應是:C6H12O6+2H2O=4H2+2CO2+2C2H4O2 或 6H12O6=2H2+2CO2+C4H8O2。它表明,從理論上說,六碳底物中最多有三分之一的電子能夠用來產生電流,而其它三分之二的電子則保存在產生的
發酵產物中,如
乙酸和丁酸鹽。總電子量的三分之一用來發電的原因在於
氫化酶的性質,它通常使用這些電子產生氫氣,
氫化酶一般位於膜的表面以便於與膜外的可活動的電子穿梭體相接觸,或者直接接觸在
電極上。同重複觀察到的現象一致,這一代謝類型也預示著高的
乙酸和丁酸鹽的產生。一些已知的製造
發酵產物的
微生物分屬於以下幾類:梭菌屬(Clostridium),產鹼菌(Alcaligenes),
腸球菌(Enterococcus),都已經從MFCs中分離出來。此外,在獨立
發酵實驗中,觀察到在無氧條件下MFC
富集培養時,有豐富的氫氣產生,這一現象也進一步的支持和驗證這一通路。
發酵的產物,如
乙酸,在低
陽極電勢的情況下也能夠被諸如泥菌屬等厭氧菌氧化,它們能夠在MFC的環境中奪取乙酸中的電子。
代謝途徑的差異與已觀測到的
氧化還原電勢的數據一起,為我們一窺
微生物電動力學提供了一個深入的視窗。一個在外部
電阻很低的情況下運轉的MFC,在剛開始在
生物量積累時期只產生很低的
電流,因此具有高的
陽極電勢(即低的MFC
電池電勢)。這是對於兼性好氧菌和厭氧菌的選擇的結果。經過培養生長,它的代謝
轉換率,體現為
電流水平,將升高。所產生的這種適中的
陽極電勢水平將有利於那些適應低氧化的兼性厭氧
微生物生長。然而此時,
專性厭氧型
微生物仍然會受到
陽極倉記憶體在的氧化
電勢,同時也可能受到跨膜滲透過來的氧氣影響,而處於生長受抑的狀態。如果外部使用高
電阻時,
陽極電勢將會變低,甚至只維持微弱的
電流水平。在那種情況下,將只能選擇適應低氧化的兼性厭氧
微生物以及
專性厭氧微生物,使對
細菌種類的選擇的可能性被局限了。
MFC中的陽極電子傳遞機制
電子向
電極的傳遞需要一個物理性的傳遞系統以完成
電池外部的電子轉移。這一目的既可以通過使用可溶性的電子穿梭體,也可以通過膜結合的電子穿梭複合體。
氧化性的、膜結合的
電子傳遞被認為是通過組成呼吸鏈的複合體完成的。已知
細菌利用這一通路的例子有Geobacter metallireducens 、嗜水氣單胞菌(Aeromonas hydrophila)以及Rhodoferax ferrireducens。決定一個組分是否能發揮類似電子門控通道的主要要求在於,它的原子空間結構相位的易接近性(即物理上能與
電子供體和受體發生相互作用)。門控的勢能與
陽極的高低關係則將決定實際上是否能夠使用這一門控(電子不能傳遞給一個更還原的
電極)。
MFCs中鑑定出的許多
發酵性的
微生物都具有某一種
氫化酶,例如布氏梭菌和微
腸球菌。
氫化酶可能直接參加了電子向
電極的轉移過程。最近,這一關於
電子傳遞方法的構想由McKinlay和Zeikus提出,但是它必須結合可移動的氧化穿梭體。它們展示了
氫化酶在還原
細菌表面的
中性紅的過程中扮演了某一角色。
細菌可以使用可溶性的組分將電子從一個
細胞(內)的
化合物轉移到
電極的表面,同時伴隨著這一
化合物的氧化。在很多研究中,都向
反應器中添加氧化型中間體比如
中性紅,
勞氏紫(thionin)和
甲基紫蘿鹼(viologen)。經驗表明這些中間體的添加通常都是很關鍵的。但是,
細菌也能夠自己製造這些氧化中間體,通過兩種途徑:通過製造有機的、可以被可逆的還原化合物(
次級代謝物),和通過製造可以被氧化的代謝中間物(
初級代謝物)。
第一種途徑體現在很多種類的
細菌中,例如腐敗謝瓦納拉菌(Shewanella putrefaciens)以及銅綠假單胞菌(Pseudomonas aeruginosa)。近期的研究表明這些
微生物的代謝中間物影響著MFCs的性能,甚至普遍干擾了胞外電子的傳遞過程。失活銅綠假單胞菌的MFC中的這些與代謝中間體產生相關的基因,可以將產生的電流單獨降低到原來的二十分之一。由一種
細菌製造的氧化型代謝中間體也能夠被其他種類的細菌在向
電極傳遞電子的過程中所利用。
通過第二種途徑
細菌能夠製造還原型的代謝中間體——但還是需要利用
初級代謝中間物——使用代謝中間物如Ha或者HgS作為
媒介。Schroder等利用E.coli K12產生氫氣,並將浸泡在
生物反應器中的由
聚苯胺保護的鉑
催化電極處進行再氧化。通過這種方法他們獲得了高達1.5mA/cm2(A,
安培)的
電流密度,這在之前是做不到。相似的,Straub和Schink發表了利用Sulfurospirillum deleyianum將硫還原至硫化物,然後再由鐵重氧化為氧化程度更高的中間物。
性能參數
底物轉化的速率
受到如下因素的影響,包括
細菌細胞的總量,
反應器中混合和
質量傳遞的現象,細菌的動力學(p-max——細菌的種屬特異性最大生長速率,Ks——細菌對於底物的親和常數),生物量的有機
負荷速率(每天每克生物量中的底物克數),
質子轉運中的質子跨膜效率,以及MFC的總電勢。
陽極的超極化
一般而言,測量MFCs的開放電路電勢(OCP)的值從750mV~798mV。影響超極化的參數包括
電極表面,電極的電化學性質,電極電勢,電極動力學以及MFC中
電子傳遞和電流的機制。
陰極的超極化
與在
陽極觀測到的現象相似,
陰極也具有顯著的電勢損失。為了糾正這一點,一些研究者們使用了赤血鹽(hexacyanoferrate)溶液。但是,赤血鹽並不是被空氣中的氧氣完全重氧化的,所以應該認為它是一個
電子受體更甚於作為
媒介。如果要達到可持續狀態,MFC
陰極最好是開放性的陰極。
轉運性能
市場性能
目前大部分的MFCs研究都使用Nafion—
質子轉換膜(PEMs)。然而,Nafion—膜對於(生物)污染是很敏感的,例如銨。而目前最好的結果來自於使用Ultrex陽離子交換膜。Liu等不用使用膜,而轉用碳紙作為隔離物。雖然這樣做顯著降低了MFC的內在
電阻,但是,在有
陽極電解液組分存在的情況下,這一類型的隔離物會刺激
陰極電極的生長,並且對於陰極的
催化劑具有毒性。而且目前尚沒有可信的,關於這些碳紙-
陰極系統在一段時期而不是短短几天內的穩定性方面的數據。
MFC的內在電阻
這一參數既依賴於
電極之間的電解液的
電阻值,也決定於
膜電阻的阻值(Nafion—具有最低的電阻)。對於最最佳化的運轉條件,
陽極和
陰極需要儘可能的相互接近。雖然
質子的遷移會顯著的影響與
電阻相關的損失,但是充分的混合將使這些損失最小化。
性能的相關數據
在平均
陽極表面的
功率和平均MFC
反應器容積單位的
功率之間,存在著明顯的差異。表2提供了目前為止報導過的與MFCs相關的最重要的的結果。大部分的研究結果都以
電極表面的mA/m以及mW/m2兩種形式表示
功率輸出的值,是根據傳統的催化
燃料電池的描述格式衍生而來的。其中後一種格式對於描述化學
燃料電池而言可能已經是充分的,但是MFCs與化學
燃料電池具有本質上的差異,因為它所使用的
催化劑(
細菌)具有特殊的條件要求,並且占據了反應器中特定的體積,因此減少了其中的自由空間和孔隙的大小。每一個研究都參照了以下參數的特定的組合:包括反應器
容積、質子交換膜、電解液、
有機負荷速率以及
陽極表面。但僅從這一點出發要對這些數據作出橫向比較很困難。從技術的角度來看,以
陽極倉內容積(液體)所產生的瓦特/立方米(Watts/m3)為單位的形式,作為反應器的性能比較的一個基準還是有幫助的。這一單位使我們能夠橫向比較所有測試過的反應器,而且不僅僅局限於已有的研究,還可以拓展到其它已知的
生物轉化技術。
此外,在
反應器的庫侖效率和能量效率之間也存在著顯著的差異。庫侖效率是基於底物實際傳遞的電子的總量與理論上底物應該傳遞的電子的總量之間的比值來計算。
能量效率也是
電子傳遞的能量的提示,並結合考慮了電壓和電流。如表2中所見,MFC中的電流和
功率之間的關係並非總是明確的。需要強調的是在特定
電勢的條件下電子的傳遞速率,以及操作參數,譬如
電阻的調整。如果綜合考慮這些參數的問題的話,必須要確定是最大庫侖效率(如對於
廢水處理)還是最大能量效率(如對於小型
電池)才是最終目標。目前觀測到的
電極表面
功率輸出從mW/m2~w/m2都有分布。
美國賓夕法尼亞州立大學環境工程系教授Bruce Logan的研究組正在嘗試開發
微生物燃料電池,可以把未經處理的污水轉變成乾淨的水,同時發電。無論對開發中國家還是已開發國家,這項“一舉兩得”的技術都相當誘人。更誘人的是,據美國國家自然
科學基金會(NSF)網站訊息,該項技術未來還可能實現海水淡化,成為“一舉三得”的技術。
最佳化
生物最佳化提示我們應該選擇合適的
細菌組合,以及促使
細菌適應反應器內最佳化過的環境條件。雖然對
細菌種子的選擇將很大程度上決定
細菌增殖的速率,但是它並不決定這一過程產生的最終結構。使用混合的厭氧-好氧型淤泥接種,並以
葡萄糖作為營養源,可以觀察到經過三個月的
微生物適應和選擇之後,細菌在將
底物轉換為
電流的速率上有7倍的增長。如果提供更大的
陽極表面供細菌生長的話,增長會更快。
批處理系統使能夠製造可溶性的氧化型中間體的
微生物的積累成為了可能。持續的系統性選擇能形成生物
被膜的種類,它們或者能夠直接的生長在
電極上,或者能夠通過生物被膜的基質使用可移動的穿梭分子來傳遞電子。
通過向批次處理的
陽極中加入可溶性的氧化中間體也能達到技術上的最佳化:MFCs中加入氧化型代謝中間體能夠持續的改善
電子傳遞。對這些代謝中間體的選擇到目前為止還僅僅是出於經驗性的,而且通常只有低的中間體
電勢,在數值約為300mV或者
還原性更高的時候,才認為是值得考慮的。應該選擇那些具有足夠高的電勢的氧化中間體,才能夠使
細菌對於
電極而言具有足夠高的流通速率,同時還需參考是以高庫侖效率還是以高能量效率為主要目標。
一些研究工作者們已經開發了改進型的
陽極材料,是通過將化學
催化劑滲透進原始材料製成的。Park和Zeikus使用錳修飾過的高嶺土
電極,產生了高達788mW/m2的輸出
功率。而增加
陽極的特殊表面將導致產生更低的
電流密度(因此反過來降低了活化
超極化)和更多的
生物薄膜表面。然而,這種方法存在一個明顯的局限,微小的孔洞很容易被被
細菌迅速堵塞。被切斷食物供應的
細菌會死亡,因此在它溶解前反而降低了
電極的活化表面。總之,降低活化
超極化和內源性
電阻值將是影響
功率輸出的最主要因素。
核心技術
污物驅動的套用在於能夠顯著的移除廢棄的底物。目前,使用傳統的
好氧處理時,氧化每千克
碳水化合物就需要消耗1 kWh的
能量。例如,生活污水的處理每立方米需要消耗0.5 kWh的
能量,折算後在這一項上每人每年需要消耗的能源約為30 kWh。為了解決這一問題,需要開發一些技術,特別是針對高強度的廢水。在這一領域中常用的是Upflow Anaerobic Sludge Blanket反應器,它產生
沼氣,特別是在處理濃縮的工業廢水時。UASB反應器通常以每立方米反應器每天10~20 kg化學需氧量的
負荷速率處理高度
可降解性的廢水,並且具有(帶有一個燃燒引擎作為轉換器)35%的總電力效率,意味著反應器
功率輸出為0.5~1 kW/m3。它的效率主要決定於燃燒沼氣時損失的
能量。未來如果發展了比現有的能更有效的氧化沼氣的化學染料
電池的話,很可能能夠獲得更高的效率。
能夠轉化具有積極市場價值的某種定性底物的
電池,譬如
葡萄糖,將以具有高能量效率作為首要目標。雖然MFCs的
功率密度與諸如
甲醇驅動的FCs相比是相當低的,但是對於這項技術而言,以底物安全性為代表的多功能性是它的一個重要優勢。
全面的看,作為一種參考,以高速率的
厭氧消化手段從
生物量中重獲
能量的資本支出約為安裝每百萬瓦生產量花費100萬瓦。後一數值也同樣適用於通過傳統的燃燒途徑、風力渦輪機以及化學染料
電池等方法利用化石燃料產能。因此這一手段也處於競爭之地。何況目前,
微生物燃料電池尚未達到這一水準的
功率輸出。
負荷速率為每天每立方米反應器0.1~10 kg的化學需氧量時,可以認為實際上能達到的
功率輸出在0.01~1.25 kW/m3之間。然而,對於好氧的處理過程,觀察到的生長速率為消耗每克有機底物產生0.4克生物量生成,而對於
厭氧發酵產生沼氣的過程這一速率理論上僅為0.077。基於MFC過程的本質,其產量應該介於這兩種代謝類型之間。觀察到的以
葡萄糖飼餵的MFCs的生長速率在0.07~0.22之間。由於廢水處理設備中
淤泥處理的花費多達每噸乾物質500,這一數量的減少對於該過程的經濟平衡具有重要的提示意義。
有效的設計和操作能夠創造一種技術平台,能夠在多種領域運用而不需要進行本質上的修改。除了經濟方面,MFCs已經展現了支柱性的核心技術的姿態。它們在低的和適中的溫度下能有效的產生
能量並轉化一系列的
電子供體,甚至即使電子供體僅以低濃度存在。在這些方面現在還沒有能夠與之相媲美的其他已知技術。
進展
微生物
燃料電池(Microbial fuel cell, MFC)是一種以產電微生物為
陽極催化劑將有機物中的化學能直接轉化為
電能的裝置,在
廢水處理和新能源開發領域具有廣闊的套用前景。雖然目前已發現很多產電
微生物,如希瓦氏菌、地桿菌、克雷伯氏桿菌等,但這些菌種均只能在中性條件下產電。理論上,鹼性條件可以抑制甲烷的產生從而有利於
電能輸出,而且鹼性廢水是工業廢水的重要組成部分。產電
微生物如何將有機物代謝產生的
電子傳遞到
電極上一直以來是MFC研究的一個重要方向,因此,研究鹼性條件下的微生物產電機制對MFC的
電能輸出與鹼性廢水的
生物處理均有重要意義。
 微生物燃料電池
微生物燃料電池中國科學院成都生物研究所套用與環境
微生物中心李大平研究員課題組在微生物
燃料電池的產電機制研究方面取得突破性進展。他們從污染環境中分離出一株嗜鹼性假單胞菌(Pseudomonas alcaliphila),該
菌株在鹼性條件下能夠分解有機物的同時產生
電能,最佳pH為9.5。通過研究發現,該菌株在MFC體系中
代謝有機物的同時產生
吩嗪-1-羧酸介體(phenazine-1-carboxylic acid,PCA),該介體起電子穿梭的作用從而實現電子從有機物到
電極的傳遞過程。
相關研究成果發表在《生物資源技術》(
Bioresource Technology) 上。(來源:中國科學院成都生物研究所)
 微生物燃料電池
微生物燃料電池 微生物燃料電池
微生物燃料電池 微生物燃料電池
微生物燃料電池 微生物燃料電池
微生物燃料電池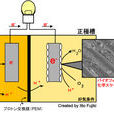
 微生物燃料電池
微生物燃料電池 微生物燃料電池
微生物燃料電池 微生物燃料電池
微生物燃料電池