基本介紹
- 中文名:局部熱力學平衡
- 外文名:Local thermodynamic equilibrium
釋義
特徵
局部熱力學平衡狀態下的電漿電導率
電導率理論模型



















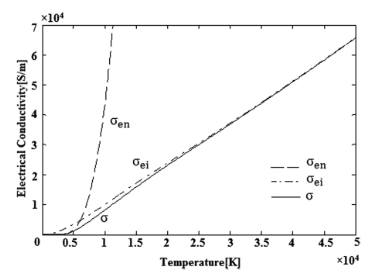
模擬計算及分析
粒子數密度




電漿電導率






















































對於氣態原子(或離子、分子)的激發的電離,如果單位時間離開某一能級的重離子數等於到達此能級的該種粒子數,並且由某一過程到達此能級的粒子數與其反過程離開此能級的粒子數均相等,這一體系就是完全熱平衡體系,也稱詳細平衡體系。在...
熱力學平衡狀態是指在不受外界作用的條件下,系統能夠長久保持而不會發生變化的一種熱力學狀態。或者說,在不受外界作用的條件下,系統巨觀熱力性質不隨時間而改變的狀態。“不受外界作用”指的是不與外界發生傳熱以及不發生功的交換。...
局部熱動平衡 為了近似地描述恆星大氣的物理狀態,K.史瓦西和米爾恩分別於1906和1921年各自提出了局部熱動平衡假設。根據這個假設,恆星大氣內任一局部小區域,都可以引入一個局部溫度來表征它的熱狀態。在這個小區域內,電子的速度分布、...
因此﹐熱動平衡規律不適用於恆星大氣整體。為了描述恆星大氣的熱狀態﹐K.史瓦西和米爾恩分別於1906年和1921年各自提出了局部熱動平衡假設(縮寫為LTE)。根據這一假設﹐恆星大氣內任一局部小區域﹐都可以引入一個局部溫度來表徵它的熱狀態...
局域熱力學平衡 局域熱力學平衡(local thermodynamic equilibrium)是2019年公布的物理學名詞。公布時間 2019年,經全國科學技術名詞審定委員會審定發布。出處 《物理學名詞》第三版。
這一實驗結論叫做熱平衡的傳遞性,或叫做熱平衡定律。熱平衡定律 如果兩個熱力學系統中的每一個都與第三個熱力學系統處於熱平衡(溫度相同),則它們彼此也必定處於熱平衡。熱平衡定律是熱力學中的一個基本實驗定律,其重要意義在於它是...
其中熱力學第零定律又稱為熱平衡定律,這是因為熱力學第一、第二定律發現後才認識到這一規律的重要性;熱力學第一定律是能量守恆與轉換定律在熱現象中的套用;熱力學第二定律有多種表述,也叫熵增加原理。發現理論 1901年,范霍夫因...
熱力學分析概述 熱力學是研究熱現象中,物質系統在平衡時的性質和建立能量的平衡關係,以及狀態發生變化時,系統與外界相互作用的學科。工程熱力學是關於熱現象的巨觀理論,研究的方法是巨觀的,它以歸納無數事實所得到的熱力學第一定律、...
熱力學系統的狀態隨時間的變化叫作熱力學過程,簡稱過程。每一時刻系統都處於平衡態的過程叫準靜態過程或準平衡過程。如果一個過程既可正向進行,也可逆向進行,而且在逆過程時系統經過的全部狀態與正過程所經歷的狀態相同只是次序相反,並...
平衡態熱力學方法又稱經典熱力學方法。是從能量觀點出發,研究巨觀平衡系統的性質,並建立平衡的一般規律的方法。它研究平衡系統的有序穩定結構,以及從一個平衡狀態過渡到另一平衡狀態的過程,即可逆過程的熱運動規律。簡介 它是物理化學...
動態平衡 從微觀看,由於組成系統的分子不停頓熱運動,微觀量隨時間作迅速的變化,保持不變的只是相應微觀量的統計平均值。所以,熱力學平衡態是一種動態平衡,稱為熱動平衡。動態平衡的狀態參量取“確定的”數值並不是絕對的,仍會發生...
例如 ,一金屬桿兩端分別始終與沸水和冰水接觸,熱量不斷從一端傳往另一端,則桿各處溫度雖然不同卻並不隨時間變化,但此桿並不處於平衡態。與單純靜止的力學平衡不同,熱平衡態是熱動平衡,系統中的分子仍在作無規則熱運動,只是...
每一個局域從巨觀上看是充分小的,因而在一個很短時刻內可看作是均勻的、平衡的;而從微觀上看又是非常大的,其內部包含著許多粒子,故仍然可看作是一個巨觀的熱力學系統。系統的這一特性,即稱為“局域平衡”。有了這個假定,便...
如果能進行,那么,在一定條件下(溫度、壓力、濃度等),這一反應能進行到什麼程度為止,其最大產量是多少,這就是化學反應的限度(指反應達到平衡或最大產量)。熱力學研究的主要依據是熱力舉第一定律和熱力學第二定律。這兩個定律是...
R.H.否勒和E.A.古根海姆還提出熱力學第三定律的另一種表述形式:任何系統都不能通過有限的步驟使自身溫度降低到0K,稱為0K不能達到原理。第零定律 熱力學第零定律:如果兩個熱力學系統均與第三個熱力學系統處於熱平衡,那么它們也...
第一部分 熱力學 第1章 引論 1.1 一些巨觀的觀念:平衡態,溫度,熱力學第零定律 1.1.1 物理系統 1.1.2 平衡態 1.1.3 態函式 1.1.4 熱力學第零定律 1.1.5 溫度 1.1.6 態函式與非態函式 1.2 一些巨觀的係數 1....
但當在熱力學研究中涉及化學反應時,需要把化學能包括到內能中。內能常用符號U表示,內能具有能量的量綱,國際單位是焦耳(J)。當系統發生某一變化,從原先的平衡態過渡到另一個新的平衡態時,內能的變化量僅取決於變化前後的系統狀態...
以上各式,反映了系統局部平衡而總體不平衡的性質,所以,這些公式就在局域平衡條件下,把非平衡熱力學系統的特性全部規定下來了。 上述方程的求解,因式(3)中的非線性函式fi({ρ})而變得困難。除了用近似方法進行計算外,里雅普諾夫...
為在環境的作用下,系統從一個平衡狀態變化到另一個平衡狀態的過程。在化工熱力學中,對熱力學過程的描述包括系統狀態的變化、經歷的途徑以及系統與環境間能量的交換。在實際過程中,系統所經歷的一系列狀態一般都是不平衡狀態,如果所...
化學平衡 主要內容是套用熱力學的平衡判據研究化學反應的平衡條件。在化學熱力學中通常把化學反應方程寫作等式,例如,在化學熱力學中將高溫下氫分子和氧分子化合成水的反應式寫為2H₂+O₂=2H₂O。溶液理論 用熱力學方法研究多組元...
這種物理狀態稱為非局部熱動平衡(NLTE)。【中文詞條】非局部熱動平衡 【外文詞條】non-local thermodynamic equilibrium 【作??者】汪珍如 在非局部熱動平衡狀態下﹐原子的激發﹑電離﹑輻射和物質的相互作用等﹐都不能簡單地用一個局部...
併兼顧了近代統計物理理論的學術思想;以此作為第二部分內容的基礎而引入《熱力學系統理論》主要內容——熱力學平衡態統計理論.第三部分講授非平衡態理論,它包括近平衡不可逆過程熱力學與非平衡態統計.第四部分講授熱力學與統計熱力學的...
第二定律和第三定律,從這些定律出發,用數學方法加以演繹推論,就可得到描寫物質體系平衡的熱力學函式及函式間的相互關係,再結合必要的熱化學數據,解決化學變化、物理變化的方向和限度,這就是化學熱力學的基本內容和方法。
工程熱力學是熱力學最先發展的一個分支,它主要研究熱能與機械能和其他能量之間相互轉換的規律及其套用,是機械工程的重要基礎學科之一。基本任務 通過對熱力系統、熱力平衡、熱力狀態、熱力過程、熱力循環和工質的分析研究,改進和完善熱力發...
先拋出熱力學第二定律:對於平衡態的孤立系統,任何時候去除一個內部約束,都會使其達到一個新的平衡,而熵永不減少。熵力定義 熵力就是一個自由能的概念,而自由能的本質就是熵和能量競爭。熵力就是自由能F的導數!熵力的概念 理...
