引言,宏基因組學的發展,環境基因組學,微生物基因組學,宏基因組學,人類宏基因組學的階段。,宏基因組的研究步驟,宏基因組的套用,宏基因組學在微生態學上的套用,宏基因組學在海洋微生物資源開發上的套用,宏基因組學在環境保護和污染修復上的套用,宏基因組學在醫學領域的套用,宏基因組學在生物酶製劑開發中的套用,宏基因組學存在的問題,參考文獻,
引言
圖1 無處不在的微生物
環境微生物是自然界中分布最廣、種類最多、數量最大的生物類群。自1663年,列文虎克利用自製顯微鏡首次揭開微生物神秘的面紗之後近300多年的時間裡,人們對於微生物的研究主要是建立在純培養基礎上, 後來人們發現通過純培養方法估計的環境微生物多樣性只占總量的0.1%~1%, 這使得微生物的多樣性資源難以得到全面的開發和利用,如何充分開拓利用環境微生物新資源是目前環境微生物研究的重要課題之一。
近年來發展起來的宏基因組學技術避開傳統的微生物分離培養方法直接從環境樣品中提取總DNA, 通過構建和篩選宏基因組文庫來獲得新的功能基因和生物活性物質, 宏基因組文庫既包括了可培養的, 又包括了未可培養的微生物遺傳信息, 因此增加了獲得新生物活性物質的機會。
宏基因組 ( Metagenome)(也稱微生物環境基因組Microbial Environmental Genome, 或元基因組)是由 Handelsman 等 1998 年提出的新名詞, 其定義為“the genomes of the total microbiota found in nature” , 即環境中全部微小生物遺傳物質的總和。它包含了可培養的和未可培養的微生物的基因,目前主要指環境樣品中的細菌和真菌的基因組總和。宏基因組學(或元基因組學,metagenomics)是一種以環境樣品中的微生物群體基因組為研究對象,以功能基因篩選和/或測序分析為研究手段,以微生物多樣性、種群結構、進化關係、功能活性、相互協作關係及與環境之間的關係為研究目的的新的微生物研究方法。一般包括從環境樣品中提取基因組DNA, 進行高通量測序分析,或克隆DNA到合適的載體,導入宿主菌體,篩選目的轉化子等工作。
特定生物種基因組研究使人們的認識單元實現了從單一基因到基因集合的轉變,宏基因組研究將使人們擺脫物種界限,揭示更高更複雜層次上的生命運動規律。在目前的基因結構功能認識和基因操作技術背景下,細菌宏基因組成為研究和開發的主要對象。細菌宏基因組、細菌人工染色體文庫篩選和基因系統學分析使研究者能更有效地開發細菌基因資源,更深入地洞察細菌多樣性。
宏基因組學的發展
宏基因組學的發展經歷了4個階段:
環境基因組學
1991年首次提出環境基因組學(environmental genomics)的概念,同年構建了第一個通過克隆環境樣品中DNA 的噬菌體文庫。
1998年美國國立環境衛生科學研究所啟動了環境基因組計畫(environmental genome project,EGP),開展有關人體遺傳變異與環境脅迫相互關係的研究。
環境基因組學第一次提出特定生態條件下,全部生物基因組總體概念,這是基因組學的重要進展。
微生物基因組學
1998年提出生命研究對象應是生物環境中全部微小生物的基因組,首次提出針對特定環境樣品中細菌和真菌的基因組總和進行研究的這一宏基因組(metagenome)概念
2007年3月,美國國家科學院以“環境基因組學新科學—— 揭示微生物世界的奧秘”為題發表諮詢報告,指出宏基因組學為探索微生物世界的奧秘提供新的方法,這是繼發明顯微鏡以來研究微生物方法的最重要進展,是對微生物世界認識的革命性突破
宏基因組學
廣義宏基因組是指特定環境下所有生物遺傳物質的總和,它決定了生物群體的生命現象。它是以生態環境中全部DNA作為研究對象,通過克隆、異源表達來篩選有用基因及其產物,研究其功能和彼此之間的關係和相互作用,並揭示其規律的一門科學
狹義宏基因組學則以生態環境中全部細菌和真菌基因組DNA作為研究對象,它不是採用傳統的培養微生物的基因組,包含了可培養和還不能培養的微生物的基因,通過克隆、異源表達來篩選有用基因及其產物,研究其功能和彼此之間的關係和相互作用,並揭示其規律
人類宏基因組學的階段。
把人體內所有微生物菌群基因組的總和稱為“人體宏基因組”(human metagenome)。
人類宏基因組學(human metagenomics)研究人體宏基因組結構和功能、相互之間關係、作用規律和與疾病關係的學科。它不僅要把總體基因組序列信息都測定出來,而且還要研究與人體發育和健康有關的基因功能。
人類宏基因組計畫目標是:把人體內共生菌群的基因組序列信息都測定出來,而且要研究與人體發育和健康有關的基因功能
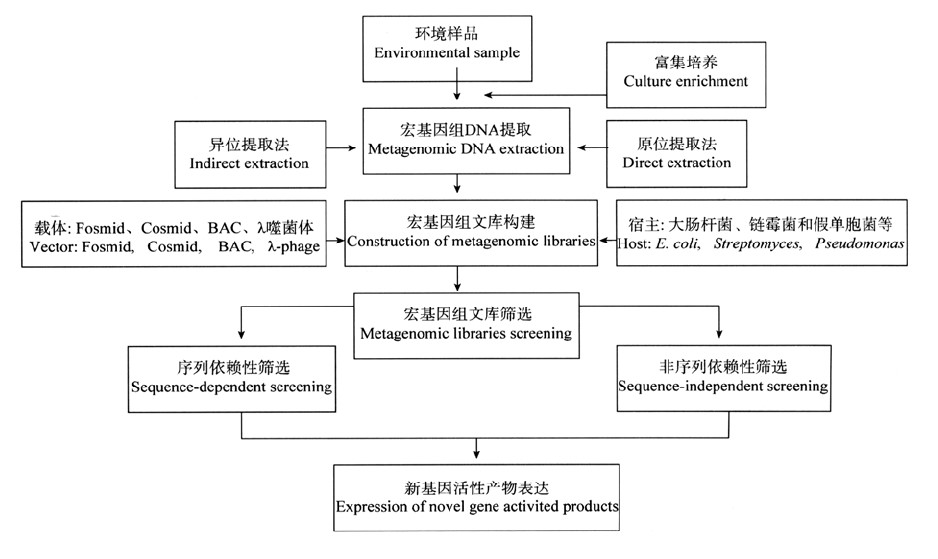
宏基因組的研究步驟
分離特定環境生物DNA。
純化大分子量DNA進行克隆。
將帶有宏基因組DNA的載體通過轉化方式轉入模式微生物建立各自的無性繁殖系。
對宏基因組文庫的DNA進行分析。
圖2宏基因組的研究步驟
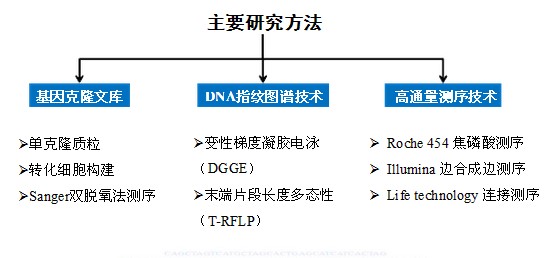
圖3宏基因組的主要研究方法
宏基因組的套用
宏基因組學在微生態學上的套用
Zhang 等構建紅樹林淤泥宏基因組文庫, 通過PCR 擴增及變性梯度凝膠電泳(DGGE)對該區域固氮菌的多樣性進行分析, 結果揭示紅樹林地區固氮菌的生物多樣性特徵, 其結果表明多數為變形菌, 也含少數的固氮菌屬、除硫單胞菌屬、德克斯氏菌屬和根瘤菌等。
張薇等採用宏基因組技術對西北黃土高原檸條種植區土壤微生物多樣性進行分析, 發現變形桿菌綱是根表土壤區系中的有優勢微生物菌群(70.3%), 尤其存在大量能夠誘導植物形成根瘤的根瘤菌和對植物有促生長作用的γ-Proteobacteria 類微生物, 說明了植物根系和土壤環境微生物菌群具有相互選擇性。
Fierer 等通過構建牧場、沙漠、雨林土壤宏基因組文庫對環境中細菌、古生菌、真菌及病毒多樣性進行了研究, 並揭示了土壤環境中包含著大量不可培養的新病毒種類, 其基因型特徵與常規培養獲得的病毒具有很大的差異性。
Kim 等通過構建稻田土壤宏基因組文庫, 利用多重置換擴增(MDA)技術對土壤樣品中病毒基因多樣性進行了研究, 結果表明擴增得到的病毒基因序列與目前報導的病毒序列具有很大的差異性, 進一步說明了土壤環境中包含著大量不可培養的病毒種類。
2003 年Breitbart 等首次通過構建宏基因組文庫對人體排泄物中的未培養病毒多樣性進行研究, 經過擴增及鳥槍測序鑑定,結果表明獲得的病毒大約有1200 種基因型, 其基因序列與先前報導的病毒序列具有很大的差異性, 多為新的基因型病毒, 並揭示存在人體中的新病毒與人類疾病可能具有一定的相互性。
2005 年Cann 等通過構建宏基因組文庫對馬排泄物中的未培養病毒多樣性進行研究, 經過測序鑑定, 獲得233 種不同基因型的病毒, 其中52%為長尾噬菌體科, 26%為未分類的噬菌體, 17%為肌病毒科, 4%為短尾病毒科,2%為脊椎動物正痘病毒。
宏基因組學在海洋微生物資源開發上的套用
宏基因組工程與海洋生物學進行有機的結合,促使人類了解許多為培養海洋微生物的基因組序列及其功能產物,在海洋天然藥物研究、海洋極端環境微生物研究、海洋微生物多樣性探索中具有十分重要的套用前景。
Martín 等構建地中海深層水體微生物宏基因組文庫, 通過序列分析和16S rRNA 系統發育比對,發現該水體的微生物種群與太平洋阿羅哈水域中層水體的微生物種群具有一定的相似性, 並提出在無光的條件下, 溫度是影響微生物種群在水體中分布的主要因素。
2008 年肖凱等以宏基因組DNA 為模板, 採用不同的PCR 引物對溫泉的高溫水底沉積物微生物多樣性進行分析, 發現了一株新的菌株JS-X2 與在美國黃石公園溫泉發現的未培養細菌有95%的相似性, 並且與嗜熱藍細菌聚球藻有89%的相似性。
Sabet 等通過構建宏基因組文庫對美國莫諾湖水體中噬菌體的多樣性進行了研究, 研究發現不可培養的噬菌體才是該特殊生境中的優勢群體, 揭示了海洋是一個巨大的未知RNA 病毒庫。
Breitbart 等通過構建海水及海底沉積物宏基因組文庫對該地區不可培養病毒的多樣性進行分析, 結果發現擴增得到的病毒基因型中65%為新的基因型, 其中包含一類海藻病毒,多數病毒具有新的基因型, 與節肢動物和高等植物病毒存在很大的序列差異性。
宏基因組學在環境保護和污染修復上的套用
挖掘降解基因和功能菌株,進行生物修復
獲取任何序列的基因或功能,由此合成新物質或發現新的生物物種。
發掘極端環境為生物的新物種,了解其耐受機制,幫助極端環境的污染修復。
從宏基因組中分離的重要基因元件組編成具有其他活性成分、或可降解污染物功能的基因簇,以替代原有不易降解化合物,或直接降解環境中石油烴、有害有害化合物、重金屬。
可以有效地從環境中分離新的基因、化合物和生物催化劑;
所構建的工程菌可用於處理各種複雜污染物,是非常有前景的降解酶系基因篩選方法;
所獲取的多樣性信息可以在廢水處理的各種反應器系統、污染物降解過程中微生物的作用和調控、營養物循環和富營養作用的微生物生態、微生物對環境和氣候的監測等研究中發揮作用;
分析微生物種群多樣性,檢測評價環境健康。
宏基因組學在醫學領域的套用
宏基因組技術的出現為新藥物的探索和發現提供了可能的技術支持, 並擴大了微生物代謝產物及分子活性物質篩選平台。例如早在2000 年, Wang 等構建土壤宏基因組文庫, 通過文庫篩選獲得TerragineA 及其相關成分, 目前已廣泛套用於醫學治療領域, 證明了自然環境中的豐富微生物代謝產物可以通過宏基因組技術為人們所利用; 同年Brady 等從土壤宏基因組文庫中篩選發現一種長鏈N-醯胺基酸抗生素物質; 並在2004 年構建鳳梨科植物樹莖流出液宏基因組文庫, 篩選鑑定獲得了抗菌物質PalmitoylPutrescine。2001 年Macneil等構建了土壤宏基因組BAC 文庫, 通過序列分析篩選獲得5 個能產生抗菌小分子物質靛玉紅並對其相關成分進行研究; 2002 年Gillespie 等構建土壤宏基因組文庫篩選獲得兩種抗菌物質Turbomycin A和B, 並且發現Turbomycin A 和B 對革蘭氏陰性和革蘭氏陽性菌具有廣譜抗菌活性; 2003 年DiazTorres 等通過構建人唾液宏基因組文庫, 篩選獲得一種新的四環素抗性基因Tet, 該活性物質對四環素具有很好的抗性; 2008 年Mori 等通過活性污泥宏基因組文庫篩選獲得兩種不同的博來黴素抗性基因, 經過比對發現於來源放射菌類基因差異較大, 可能為新的博來黴素抗性基因。
國內在利用宏基因組技術獲取新型藥物的研究較少, 尚處於萌芽階段, 趙晶等從南極中山站排污口採集污泥,構建宏基因組文庫, 並通過差異性DNA 修復實驗(DDRT)篩選得到具有抗腫瘤效應的物質。同時利用宏基因組技術研究探討人類腸道中不可培養微生物多樣性也有了很大進展。如Kurokawa 等利用宏基因組技術對13 個處於不同年齡層的健康人體糞便微生物種群進行了研究, 結果分析表明未斷奶嬰兒的腸道微生物種群在系統發育和基因組成上具有較大個體差異性, 而在成人及已斷奶兒童則呈現出高度的功能一致性, 並對成人及嬰兒腸道內編碼該生境微生物主要功能的基因家族的特性進行分析, 發現了一個新的人類腸道微生物基因家族和一個共扼轉座子。2003 年Breitbart 等通過構建宏基因組文庫對人體排放物中的未培養病毒多樣性進行研究,經過鳥槍測序法鑑定, 獲得的病毒大約有1200 種基因型, 結果比對表明其基因序列與先前報導的病毒具有很大的差異性, 大多數為新病毒, 並證明這些病毒極有可能與人類的疾病有著密切的關係。2008 年Finkbeiner 等通過構建12 個腹瀉小孩腸道內容物宏基因組文庫, 來觀察病人腸道中病毒的生物多樣性, 發現擴增得到的病毒序列與GenBank 病毒庫中的已知序列同源性很低, 並推斷這些病毒極有可能與人類的腹瀉疾病有著密切的關係。隨著宏基因組技術的成熟, 必將加快宏基因組技術在醫學中的套用。在人體微生物抗藥性的研究, 人體與不可培養病原菌的相互關係的探索等方面將做出重大貢獻。
宏基因組學在生物酶製劑開發中的套用
宏基因組學技術最引人注目的貢獻主要集中在新型生物酶製劑的探索和開發領域。傳統的新型酶的篩選方法大大限制了篩選的廣泛性和有效性。宏基因組學通過直接從環境中提取DNA 樣品,儘可能為後面的篩選提供更加全面和多樣的基因資源,從而有效地提高了新酶的篩選效率。
近年來研究者們已成功構建了土壤、海底淤泥、溫泉淤泥、油廠污泥、動物瘤胃內容物、動物糞便等宏基因組文庫,並篩選到脂肪酶、蛋白酶、澱粉酶、乙醇氧化酶、木聚糖酶、纖維素酶及脫羧酶等酶製劑, 並且在此基礎上獲得新酶的許多特徵信息。所採用的載體種類十分廣泛, 包括Fosmid、Cosmid、BAC、λ噬菌體以及各種穿梭載體, 所採用的宿主系統為常用的大腸桿菌、鏈黴菌和假單胞菌等。通過宏基因文庫篩選得到的生物分子大多數與已知的基因產物相似性差或者完全是新的分子, 這些新的生物分子主要來源於環境未培養微生物的基因和其多樣的代謝物。
環境樣品DNA 的克隆和篩選只是所有環境遺傳信息多樣性的一小部分, 環境微生物和宏基因組的多樣性仍舊是發現新的天然活性產物的豐富廣闊資源, 為研究者們探索開發新的生物催化劑提供了巨大的資源空間。
宏基因組學存在的問題
文庫的質量,目前已發表的文庫很少能夠覆蓋整個宏基因組,這需要進一步最佳化DNA的提取及克隆方法。
高通量的有效篩選平台,目前從幾萬或幾十萬個克隆中只能篩選到幾個有活性的基因,這主要是由於微生物多樣性高,宏基因組比較複雜,以及外源基因在宿主菌中的表達障礙等等。
宏基因組學研究主要集中於原核生物,對真菌等真核生物研究較少,所構建文庫多為DNA文庫,cDNA文庫較少。
參考文獻
黃循柳, 黃仕傑, 郭麗瓊,林俊芳.宏基因組學研究進展.微生物學通報.JUL 20, 2009, 36(7): 1058~1066
Brady SF, Clardy J. Long-chain N-acyl amino acid antibiotics isolated from heterologously expressed environmental
DNA. J Am Chem Soc, 2000, 122(51):12903−12904.
Majernik A, Gottschalk G, Daniel R. Screening of environmental DNA libraries for the presence of genes conferring Na+(Li+)/H+Antiporter activity on Escherichia coli:Characterization of the recovered genes and the corresponding gene products. J Bacteriol, 2001, 183(22):6645−6653.
Uchiyama T, Abe T, Ikemuraet T, et al. Substrate induced gene expression screening of environmental metagenome libraries for isolation of catabolic genes. Nat Biotechnol,2005, 23(1): 88−93.
Williamson LL, Borlee BR, Schloss PD, et al. Intracellular screen to identify metagenomic clones that induce or inhibit a quorum-sensing biosensor. Appl Environ Microbiol,2005, 71(10): 6335−6344.
Martín-Cuadrado AB, López-García P, Alba JC, et al.Metagenomics of the deep mediterranean, a Warm Bathypelagic Habitat. PloS-ONE, 2007, 2(9): 9−14.
Zhang Y, Dong J, Yang Z, et al. Phylogenetic diversity of nitrogen-fixing bacteria in mangrove sediments assessed by PCR–denaturing gradient gelelectrophoresis. Arch Microbiol,2008, 190(1): 19−28.
張 薇, 胡躍高, 黃國和, 等. 西北黃土高原檸條種植區土壤微生物多樣性分析. 微生物學報, 2007, 47(5):751−756.
肖 凱, 曹理想, 陸勇軍, 等. 廣東金山溫泉沉積物中原核與真核微生物多樣性初步分析. 微生物學報, 2008,48(6): 717−724.
Fierer N, Breitbart M, Nulton J, et al. Metagenomic and small-subunit rRNA analyses reveal the genetic diversity of bacteria, archaea, fungi, and viruses in soil. Appl Environ Mi c ro b i o l , 2 0 0 7 , 7 3 ( 2 1 ) : 7 0 5 9 − 7 0 6 6 .
Kim KH, Chang HW, Nam YD, et al. Amplification of uncultured single-stranded DNA viruses from rice paddy soil. Applied and Environmental Microbiology, 2008,74(19): 5975−5985.
Sabet S, Chu WP, Jiang SC. Isolation and genetic analysis of haloalkaliphilic bacteriophages in a north American Soda lake. Microbial ecology, 2006, 51(4): 543−554.
Breitbart M, Salamon P, Andresen B, et al. Genomic analysis of uncultured marine viral communities. Proc Natl Acad Sci USA, 2002, 99(22): 14250−14255.
Breitbart M, Hewson I, Felts B, et al. Metagenomic analyses of an uncultured viral community from human feces.J Bacteriol, 2003, 185(20): 6220−6223.
Cann A, Fandrich S, Heaphy S. Analysis of the virus population present in equine faeces indicates the presence of hundreds of uncharacterized virus genomes. Virus Genes,2005, 30(2): 151−156.
Wang GY, Graziani E, Waters B, et al. Novel natural products from soil DNA libraries in a streptomycete host.Org Lett, 2000, 2(16): 2401−2404.
Brady SF, Clardy J. Palmitoylputrescine, an antibiotic isolated from the heterologous expression of DNA extracted from bromeliad tank water. J Nat Prod, 2004,67(8): 1283−1286.
MacNeil IA, Tiong CL, Minor C, et al. Expression and isolation of anti microbial small molecules from soil DNA libraries. J Mol Microbiol Biotechnol, 2001, 3(2):301−308.
Gillespie DE, Brady SF, Bettermann AD, et al. Isolation of anti-biotics turbomycin A and B from a metagenomic library of soil microbial DNA. Appl Environ Microbiol,2002, 68(9): 4301−4306.
DiazTorres ML, McNab R, Spratt DA, et al. Novel tetracycline resistance determinant from the oral metagenome. Antimicrob Agents Chemother, 2003, 47(4): 1430−1432.
Mori T, Mizuta S, Suenaga H, et al. Metagenomic screening for bleomycin resistance genes. Appl Environ Microbiol, 2008, 74(21): 6803−6805.
趙 晶, 楊祥勝, 曾潤穎. 南極土壤微生物宏基因組文庫構建及其抗腫瘤活性初探. 自然科學進展, 2007,17(2): 267−271.
Kurokawa K, Itoh T, Kuwahara T, et al. Comparative metagenomics revealed commonly enriched gene sets in human gut microbiomes. DNA Research, 2007, 14(4):169−181.
Finkbeiner SR, Allred AF, Tarr PI. Metagenomic analysis of human diarrhea: Viral detection and discovery. PLoS Pathogens, 2008, 4(2): 1−9.