適應症
1.實體瘤骨轉移和多發性骨髓瘤
用於多發性骨髓瘤和實體瘤骨轉移患者中骨相關事件預防。
2.骨巨細胞瘤
用於治療不可手術切除或者手術切除可能導致嚴重
功能障礙的骨巨細胞瘤,包括成人和骨骼發育成熟(定義為至少1處成熟
長骨且體重≥45 kg)的青少年患者。
3、骨質疏鬆症
用於骨折高風險的絕經後婦女的骨質疏鬆症。在絕經後婦女中,本品可顯著降低椎體、非椎體和髖部骨折的風險。
用於骨折高風險的男性骨質疏鬆症,可幫助患者改善骨量,降低骨折發生的風險。
研發歷程
安加維
2020年11月20日,百濟神州宣布中國國家藥品監督管理局(NMPA)用於預防實體瘤骨轉移及多發性骨髓瘤引起的骨相關事件(SRE);
2021年3月1日,2020年國家醫保藥品目錄正式啟用,其中包括國內首個且唯一的
RANKL抑制劑
安加維(地舒單抗注射液,120mg)。
2022年11月10日,綠葉製藥集團宣布,其
控股子公司博安生物自主研製的地舒單抗注射液正式獲得國家藥品監督管理局的上市批准,用於
骨折高風險的絕經後婦女的
骨質疏鬆症,該藥是首個國產地舒單抗注射液。
普羅力
2001年6月30日,第一支地舒單抗被注射進入人體。
2004年,第一個用於絕經後女性骨質疏鬆症的地舒單抗單劑量研究發表於JBMR。
2006–2009年,地舒單抗關鍵臨床試驗完成,結果發布於NEJM。
2010年,獲美國食品藥品監督管理局(FDA)批准用於治療骨折高風險的絕經後婦女的骨質疏鬆症。
2020年,獲國家藥品監督管理局(NMPA)批准用於治療有骨折高風險的絕經後婦女的骨質疏鬆症。
2023年,獲國家藥品監督管理局(NMPA)批准用於治療有骨折高風險的男性骨質疏鬆症。
指南與專家推薦
2020年,美國臨床內分泌醫師學會(AACE)和美國內分泌學院(ACE)聯合發布了更新的絕經後骨質疏鬆症的診斷和治療指南:對於高骨折風險的患者,地舒單抗被推薦為初始治療藥物之一。
2020年更新的美國內分泌學會(TES)女性絕經後骨質疏鬆症的藥物治療指南:推薦地舒單抗為骨折高風險絕經後骨質疏鬆症患者的初始治療選擇。
中國《原發性骨質疏鬆症診療指南(2017)》:通常首選使用具有較廣抗骨折譜的藥物(如阿侖膦酸鈉、唑來膦酸、利塞膦酸鈉和地舒單抗(迪諾塞麥) 等);對口服不能耐受、禁忌、依從性欠佳及高骨折風險者(如多發椎體骨折或髖部骨折的老年患者、骨密度極低的患者) 可考慮使用注射製劑(如唑來膦酸、特立帕肽或地舒單抗(迪諾塞麥)等)。
中國《原發性骨質疏鬆症診療指南(2022)》:對於骨折高風險者建議首選口服雙膦酸鹽( 如阿侖膦酸鈉、利塞膦酸鈉等) ; 對於口服不耐受者可選擇唑來膦酸或地舒單抗; 對於極高骨折風險者,初始用藥可選擇: 特立帕肽、唑來膦酸、地舒單抗、羅莫佐單抗或續貫治療; 而對於髖部骨折極高風險者,建議優先選擇唑來膦酸或地舒單抗。
臨床試驗
在絕經後骨質疏鬆症婦女中的臨床有效性和安全性
在絕經後骨質疏鬆症婦女中開展的全球III期有效性和安全性研究。
在基線腰椎或全髖骨密度(BMD)T評分在 -2.5和-4.0之間,且主要骨質疏鬆性骨折與髖部骨折10年平均絕對骨折機率分別為18.60%(十分位數:7.9-32.4%)和7.22%(十分位數:1.4-14.9%)的絕經後婦女(7808名年齡60-91歲的婦女,其中23.6%具有再發性椎體骨折)中研究了本品每6個月給藥一次,連續治療3年時的有效性和安全性。患有其他疾病或接受可能影響骨骼的治療的女性被排除在本項研究之外。女性患者每天補充鈣(至少1000 mg)和維生素D(至少400 IU)。
對椎體骨折的影響:
在治療的第1、2和3年,本品可顯著降低新發椎體骨折風險(p < 0.0001)(見表2)。
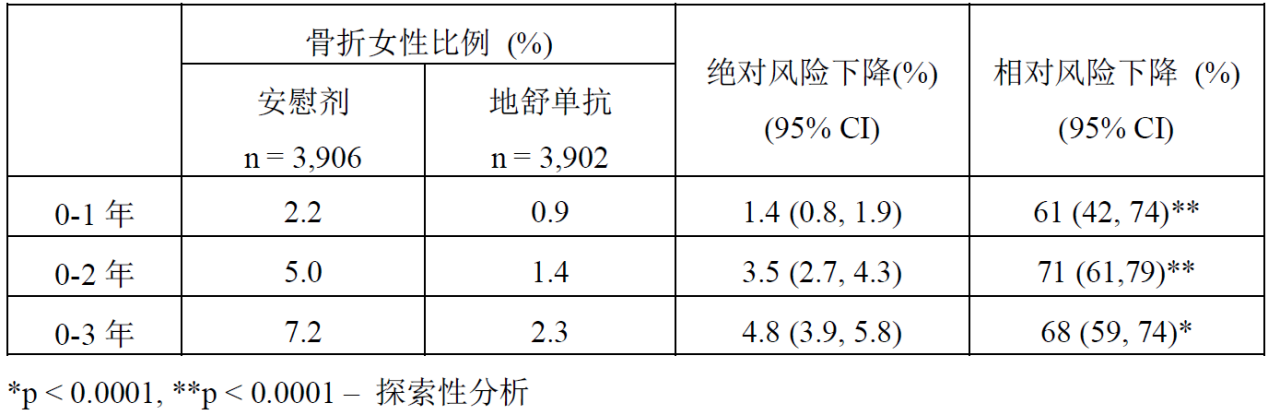
表 2.地舒單抗對新發椎體骨折風險的影響
對髖部骨折的影響:
接受地舒單抗治療3年後,髖部骨折風險相對下降了40%(絕對風險下降0.5%)(p < 0.05)。在第3年,安慰劑組髖部骨折發生率為1.2%,地舒單抗組為0.7%。
在一項針對>75歲婦女的事後分析中,地舒單抗組的相對風險下降了62%(絕對風險下降1.4%,p < 0.01)。
對所有臨床骨折的影響:
本品可顯著降低所有類型/組別的骨折(見表3)。
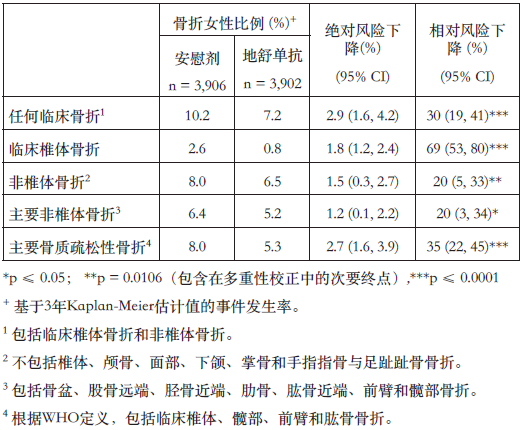
表3. 第3年地舒單抗對臨床骨折風險的影響
在基線股骨頸BMD ≤ -2.5的婦女中,本品可降低非椎體骨折風險(相對風險下降35%,絕對風險下降4.1%,p < 0.001,探索性分析)。
無論10年基線骨折風險如何,本品3年內新發椎體骨折、髖部骨折和非椎體骨折的發生率均一致降低。
對骨密度的影響:
在治療第1、2年3年,與安慰劑相比,地舒單抗組中所有測量的臨床部位的BMD均升高。在第3年,地舒單抗組腰椎BMD升高9.2%,全髖BMD升高6.0%,股骨頸BMD升高4.8%,髖部轉子BMD升高7.9%,橈骨遠端1/3處BMD升高3.5%,全身BMD升高4.1%(均p < 0.0001)。
在觀察停止地舒單抗治療後的影響的臨床研究中,BMD在末次給藥後18個月內大致恢復至治療前水平,並保持高於安慰劑組。這些數據表明地舒單抗需要連續治療方可維持治療作用。重新開始地舒單抗治療可使BMD升高,且與首次治療時相似。
治療絕經後骨質疏鬆症的開放標籤擴展研究
共4550名在上述關鍵性研究中錯過試驗用藥給藥不超過1次並完成了第36個月研究訪視的婦女(地舒單抗組2343名,安慰劑組2207名)同意入組這項7年、多國、多中心、開放標籤、單組、擴展研究來評價地舒單抗的長期安全性和有效性。在擴展研究中,所有女性患者每6個月接受一次地舒單抗 60 mg治療,同時每天補充鈣(至少1 g)和維生素D(至少400 IU)。共有2626名受試者(擴展研究中58%的女性,即關鍵研究中34%的女性)完成本項擴展研究。
在接受地舒單抗治療長達10年的患者中,與關鍵研究的基線相比,腰椎的BMD升高21.7%,全髖BMD升高9.2%,股骨頸BMD升高9.0%,轉子BMD升高13.0%, 橈骨遠端1/3處BMD升高2.8%。在接受10年治療的患者中,研究結束時平均腰椎BMD T評分為-1.3。
將骨折發生率作為安全性終點進行了評估,由於終止治療的患者數量較多且為開放標籤研究設計,因此無法評估對骨折預防的有效性。在接受地舒單抗治療10年的患者(n=1278)中,新發椎體和非椎體骨折的累計發生率分別約為6.8%和13.1%。因任何原因而未能完成研究的患者的治療期間骨折發生率升高。
在擴展研究中發生了13例經裁定的頜骨壞死(ONJ)和2例經裁定的非典型股骨骨折。
絕經後骨質疏鬆症婦女的骨組織學
在地舒單抗治療1-3年後評價了62名未接受過骨質疏鬆症治療或從既往阿侖膦酸鈉治療轉換為本品治療的骨質疏鬆症或低骨量絕經後婦女的骨組織學。59名婦女在絕經後骨質疏鬆症擴展研究第24個月(n=41)和/或第84個月(n=22)參與了骨活檢研究。骨活檢結果顯示:骨骼的結構和質量正常,未見礦化缺陷、編織骨或骨髓纖維化證據。絕經後骨質疏鬆症婦女的擴展研究中進行的組織形態學檢測結果顯示了地舒單抗的抗骨吸收作用(通過激活頻率和骨形成速率來衡量)可隨時間的延長而持續存在。
在患有骨質疏鬆症男性中開展的全球III期有效性和安全性研究
相對於安慰劑,普羅力治療12個月,顯著提升腰椎、全髖、股骨頸、股骨轉子等關鍵部位的骨密度;治療24個月骨密度持續提升,腰椎與全髖骨密度與基線相比增加8.0%和3.4%。
規格
安加維:120 mg (1.7 mL) /瓶
普羅力:60 mg(1.0 ml)/支(預充式注射器)
批准文號
安加維: S20190025
普羅力:S20200019