簡介
參考劑量由
美國環境保護局(EPA)首先提出,用於非致癌物質的危險度評價。RfD為環境介質(空氣、水、土壤、食品等)中外源化學物的日平均接觸劑量的估計值。人群(包括敏感亞群)在終生接觸該劑量水平外源化學物的條件下,預期一生中發生非致痛或非致突變有害效應的危險度可低至不能檢出的程度。
在制定安全限值時,毒理學資料是重要的參考依據,其中最重要的毒性參數是LOAEL和NOAEL。外源化學物的安全限值一般是將LOAEL或NOAEL縮小一定的倍數來確定的。這個縮小的倍數稱為安全係數或不確定係數。在選擇安全係數或不確定係數時要考慮多種因素,如外源化學物的急性毒性等級、在機體內的蓄積能力、揮發性、測定LOAEL或NOAEL採用的觀察指標、慢性中毒的後果、種屬與個體差異大小、中毒機制與代謝過程是否明了等。需要說明的是,經驗在安全係數或不確定係數的選擇上會起到很大的作用,故最後確定的數值大小常帶有一定的主觀色彩。
RfD可根據試驗中可獲得的NOAEL和LOAEL兩個具體參數值計算而來。
式中:
NOAEL——未觀察到損害作用劑量
LOAEL——最低觀察到損害作用劑量
SF——安全係數
MF——修正係數
SF(safety factor)為安全係數,是根據毒理學試驗所得的未觀察到損害作用劑量(NOAEL)提出安全限值時,為解決由動物試驗資料外推至人的不確定因素及人群毒性資料本身所包含的不確定因素而設定的轉換係數。這些不確定因素是由實驗動物和人的種間差異和人群間的個體差異所致。上述兩方面的差異值來源於毒代動力學與毒效應動力學的資料。國際規章機構承認非致癌物的100倍安全係數。採用100倍安全係數的依據是,人對各種有毒有害物質的敏感性一般要比最敏感的動物還要敏感10倍,而實驗動物種內個體差異又約10倍,所以,對非致癌物安全限值計算中就使用了100倍安全係數。為了確保全全,慎重起見,致癌、致畸物的安全係數制定得要大一些,根據不同情況有不同規定。
MF(modifying factor)為修正係數,是主要考慮研究的科學性以及各種未能包括的不確定因素。例如,有無作用機制方面的資料,受試物所致實驗動物的損害作用是否與人類相似等。一般MF<10。當研究中的不確定因素可由SF予以充分估計時,MF取值為1。
如何用基準劑最法推導參考劑量
NOAEL/LOAEL法制定參考劑量存在的問題
根據傳統的NOAEL/LOAEL法制定參考劑量存在很多的問題。這些問題包括:
(1)傳統方法沒有包括劑量一效應曲線形狀的信息,只是注重單個點(NOAEL或LOAEL)。
(2)NOAEL值取決於實驗的劑量個數與劑量間隔。可能的NOAEL值僅限於實驗劑量的離散值。從理論上講,實驗的無不利影響劑量可以是實驗的NOAEL和LOAEL之間的任意值,有時真正的NOAEL低於觀測到的NOAEL,尤其是在各個劑量組中動物個數有限的研究中。
(3)沒有直接考慮數據的變化。例如,動物個數較多的研究可能會比動物個數較少的研究在更低的劑量上檢測出影響;其結果是來自同一物種的一個小規模研究的NOAEL可能會高於來自一個類似的但大規模研究的NOAEL。傳統方法沒有考慮此類數據變化的機制。
(4)NOAEL的確定取決於在對照組動物中影響的背景發生率,因此,如果背景發生率較高,則劑量組和對照組之間的統計學顯著差異是更難以檢測出來的,即使發生了生物學的顯著影響也是如此。
(5)與暴露數據相結合,可用基於NOAEL的參考劑量來估算處於風險中的人群大小,而不是風險的大小。
針對這些問題,已經建立了試圖解決這些4i足中的某些問題的備選方法。一個這樣的備選方法一基準劑量法,是過去10年中廣泛研究的主題。EPA風險評價論壇正在制定有關基準劑量計算所用到的程式和模型的指南。
用基準劑量法計算參考劑量
採用
基準劑量法確定參考劑量涉及4個基本步驟。第一步選擇用於基準劑量建模的實驗和反應。第二步計算所選反應的基準劑量,應計算所有可能得出臨界基準劑量的終點的基準劑量值。第三步是從這些計算得出的基準劑量中選出一個基準劑量。最後一步是通過將選中的基準劑量除以適當的不確定性係數來計算參考劑量。與這些步驟相關的決策點列於圖1中。隨後的討論總結了基準劑量法所特有的關鍵問題,主要依據來自Crump等(1995)的信息。
 圖1
圖1(1)選擇反應數據建模
選擇適合於基準劑量建模的實驗和反應所需考慮的事項與確定作為NOAEL依據的合適研究相類似。一種化學物質可能有幾個可建模的合適研究和相關的健康影響。理想的是,進行整套相關影響的基準劑量計算。但是,利用所有相關反應來計算基準劑量可能是資源密集型的。此外,解釋大量的劑量一效應分析結果是很困難的。當選擇數據建模時合適的做法是將注意力限制在有劑量一效應關係證據的那些反應上。從統計學上看,這種關係可由反應隨著劑量水平增加的顯著趨勢(增加或減小)來顯示。也可能需要考慮證明生物學意義。另一個可供選擇的做法是將精力集中在建模最關鍵的影響上,如同在LOAEL中見到的那樣。但是,限制建模的反應個數可能會不能如實地表示最小的基準劑量。
(2)使用分類與連續數據
選擇數據來建模時的一個中心問題是所用數據的形式。分類數據,尤其是量子數據,可以較為直接地用於基準劑量法中,因為數據是以給定劑量下表現出確定反應的受試者個數(或百分比)來表示的。數據也可以是連續形式,其中結果是以連續的生物學終點的測定來表示的,例如器官重量或血清酶濃度的變化。採用連續數據時,結果通常是以劑量組的平均值或標準偏差來表示的,但在單個動物的數據可獲得時是最有價值的。要進行此類數據的劑量一效應建模,必需確定正常反應與不良反應的界限。連續數據可以通過將各個劑量組的平均反應看做是對照組的平均反應的一部分或者作為在各個劑量水平表現出不良反應的動物百分比來進行建模。該方法利用了反應數據的連續性,但是以直接類似於從分類數據分析中推導得出的結果的方式表示結果,例如以附加風險或額外風險表示,而不是以平均反應的變化來表示。Crump(1995)提供了處理可套用於與量子終點分析所用的相同模型的連續數據的選項。該進展提高了任何一種具體化學物質不同終點間結果的一致性。在任何情況下,將基準劑量法套用於連續數據需要專業判斷,以便確定哪個效應劑量或類別造成了異常(不良)影響。不推薦常規套用基準劑量法,但在數據可獲得且有理由需要廣泛分析時可以套用。
(3)選擇數學模型
各種數學方法已被提出用於確定基準劑量。圖2列出了一些可與量子數據或連續數據一起估算基準劑量的劑量一效應模型。EPA基準劑量模型程式包括了運用量子數據的伽馬、對數、多級、常態分配、量子線性、量子二次和威布爾軟體模型的方法。線性、多項式、冪和希爾模型可與連續數據一起使用。
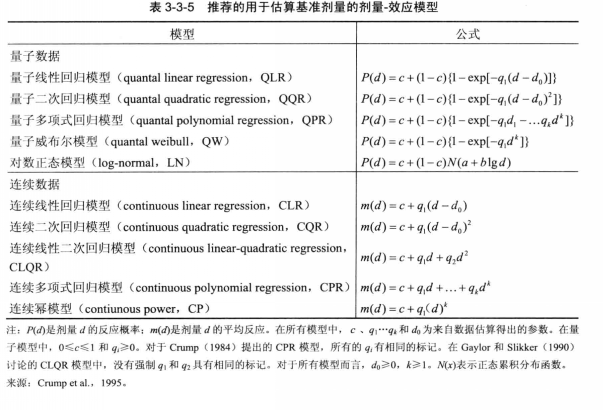 圖2
圖2分類數據(包括量子數據)套用於劑量一效應模型通常需要的信息包括實驗劑量、各個劑量組中的動物數、其反應在各個反應類別中的個數。對於連續數據而言,則需要實驗劑量、各個劑量組中的動物數、各個組中的平均反應以及各個劑量組中的反應樣本差異。
基準劑量法不得套用於只有2個實驗組(一個對照組和一個陽性劑量組)的數據集。在這種情況下,基準劑量法有關考慮劑量一效應曲線形狀方面的許多優勢將會喪失;這樣的數據提供了極少的有關劑量一效應曲線形狀的信息。可用的劑量越多,尤其是在較低劑量時,基準劑量法與NOAEL法相比的預期優勢就越大。
(4)處理模型擬合
將模型與實驗數據擬合將得到有助於確定數據擬合最佳模型的參數估算值。該擬合通常是由最大似然法完成的,估算各個劑量值的反應機率(量子數據)或平均反應(連續數據)。可用擬合優度檢驗來確定一個模型是否充分描述了劑量一效應數據。實驗數據應根據模型設計繪圖,從而提供擬合的可視化表示形式。在許多情況下,有幾個模型看起來好像都能很好地與數據擬合。在這種情況下,可用其他考慮因素來選擇一個適當的模型。例如,支持模型的統計學假設對於給定數據應該是合理的。舉例來說,假定量子結果為遵循劑量相關期望值的二項分布。該假設需要每個受試者的獨立反應且所有受試者均有相等的反應機率。假定各個劑量值的連續反應遵循
常態分配並且還假定是獨立的。當生物學因素可能重要時(例如發育毒性數據的窩內相關性),它們也可用於選擇適當的模型。另一個生物學考慮因素可能為是否存在一個假定的閾值。如果給定影響有一個期望的閾值,則可以選擇一個考慮了閾值劑量的模型進行建模。劑量—效應曲線形狀的生物學似真性應當總是模型選擇過程中的一個考慮因素。
即使有這些考慮因素,通常可能有幾個不同的模型可充分描述數據。在這種情況下,檢查有關基準反應的擬合是很重要的。對整個數據集有相似擬合的模型可能在基準反應附近的預測值有所不同。可根據更局部的特性來從中選擇一個模型。對於某些數據集來說,沒有一個標準的模型可合理地擬合數據。擬合通過比較模型預測值與觀察值進行統計學上的評價。擬合優度統計使比較正式化,並提供了範圍在0和1之間的P值作為擬合的量度。當運用χ2統計時,較大的P值表示擬合較好:較小的P值表示擬合較差。足夠小的P值(如小於0.01或0.05)通常認為模型不足以描述所觀測到的劑量一效應模式。
較差的擬合通常是由於較高劑量下的反應降低,這與較低劑量的劑量.效應趨勢是不相符的,可能是由於競爭性的毒性過程或所關注的毒性反應有關的代謝系統飽和的緣故。在這種情況下,有幾個程式可用來調整建模過程。例如,最高劑量下的反應可被排除,因為這些劑量通常對所關注的較低劑量區域的反應所提供的信息是最少的。當代謝途徑飽和的情況下,毒物代謝動力學數據可用來估算輸送到相關器官的劑量。隨後可就有效劑量進行基準劑量建模。
與觀測值有關的模型預測值的外觀(圖形)檢查是一個與所有這些擬合問題相關的基本做法。這補充了擬合的正式統計學評價,實際上可能同樣或更多地提供信息。生物學似真性是從幾個選項中選出最佳基準劑量要考慮的另一個關鍵因素。
(5)測定變化的反應
Crump(1984)提出了有關量子數據反應增加的兩種量度,即附加風險和額外風險。附加風險是劑量d的反應機率P(d),減去零劑量(對照反應)的反應機率P(0)。它描述了有劑量存在時發生反應的動物的增加比例。額外風險是附加風險除以(1一P(0))。它描述了有劑量存在時發生反應的動物的增加比例,除以在對照條件下不發生反應的動物比例。這兩種量度的區別在於其考慮對照反應的方式。例如,如果一個劑量將反應從0%增加到1%,則附加風險和額外風險都是1%。但是,如果一個劑量將風險從90%增加到91%,則附加風險仍然是1%,但額外風險是10%。額外風險與附加風險的選擇在一定程度上是基於一種化合物是否增加背景風險的假設。將額外風險作為默認值,因為它更為保守。
有關連續數據的風險類似量度已被提出(Crump,1984)。第一種量度反應的變化可表示為劑量d的平均反應減去對照平均反應的差值。第二種量度只是劑量和對照的平均反應的差除以對照平均反應(即標準化),它將變化表示為對照反應的分數,而不是絕對變化量。
對連續終點基準劑量的最新考慮提出了其他選項。Allen等和Kavlock等決定採用平均反應乘以背景標準差對變化進行標準化,得到平均值與NOAEL相當的基準劑量。對於這些研究者研究的發育終點,標準差的最佳乘數為0.5。
與背景(即額外風險)相比所表示的風險量度什麼時候優於以絕對變化表示的量度還不清楚。需要其他研究來提供有關特定情形下最適合的反應變化量度的指導。
(6)選擇基準反應
推導基準劑量的一個關鍵決定就是選擇基準反應(BMR)。由於基準劑量的運用如同推導參考劑量中的NOAEL一樣,所以基準反應應當在研究所檢測到的影響的范闈下限附近選取。預期會導致受試群體中影響發生率增加10%的劑量(ED10)通常被選為基準反應。對某些數據而言,可充分估算ED5或ED1,這是一個更接近真實的無影響劑量。但是,在許多情況下,ED10是可從標準的毒性研究中估算出的最低風險劑量(Crump,1984)。
在EPA主辦的基準劑量研討會期間,與會者一致認為適當的基準反應應該或者為5%,或者為10%,似他們也承認未來的研究可能會證明從這兩個值中選出一個值是更為明智的。Allen等和Faustman等的研究表明,基準劑量定義為反應機率增加10%平均說來往往是類似於量子發育毒性研究所對應的NOAEL。為了推導水質基準,EPA建議在推導基準劑量時採用ED5或ED10。
(7)計算置信區間
基準劑量被定義為所選基準反應相應劑量的置信下限。採用統計學置信下限,而不是最人似然估算值(maximum likelihood estimate,MLE)有幾個原因。運用置信限考慮了群體的變異性。人部分生物學反應在一個群體內是呈常態分配的。因此,如果要從群體中隨機選出兩組動物進行研究,一個研究組中的最低效應劑量的反應個體可能會與暴露。同樣實驗條件下的第二組的有所不同。使用置信區間下限提高了一個小規模動物組的研究結果可被外推至整個群體的置信度。
要計算反應的置信上限和有效劑量的置信下限,必需選擇一個計算置信限和置信限大小的程式。推薦的用於計算曲線置信區間的方法取決於最大似然原理。該方法與EPA用於癌症劑量一效應模型電腦程式中的方法相同。該方法可用於運用EPA Benchmark軟體以及其他商業上獲得的基準程式的基準劑量建模。
通過轉換,統計學置信限的大小範圍可在90%~99%。置信限的計算方法以及置信區間的選擇是至關重要的。EPA建議基準劑量模型採用單側第95百分位置信限。這與癌症劑量一效應模型中採用的置信限的大小一致。
(8)選擇基準劑量作為參考劑量的依據
當計算得出多個基準劑量時,一個重要的決定就是選擇用於參考劑量計算過程中合適的基準劑量。當不同的模型適合一個研究的反應數據時,當一個研究中不止一個反應被建模以及當來自不同研究的不同基準劑量存在時,均可計算出多個基準劑量。在由適合單一數據集的多個模型計算得出多個基準劑量時,分析人員可選擇最小的基準劑量或通過平均值來綜合得出基準劑量。當從檢查同一終點的不同反應或不同研究計算得出多個基準劑量時,基準劑量的選擇也可能涉及選擇“臨界影響”以及最適合的物種、性別或其他有關的實驗設計特徵。模型輸出與實驗數據的圖形表示以及對生物作用模式的理解可有助於基準劑量的選擇。
(9)基準劑量法不確定性係數的套用
一旦選擇了單一基準劑量或平均基準劑量,則可通過將基準劑量除以一個或多個不確定性係數來計算參考劑量。作為默認設定,應考慮所有的用於傳統的基於NOAEL的參考劑量法中適用的不確定性係數,但LOAEL—NOAEL外推係數除外。其他係數(如基準反應和置信限)的大小、生物學考慮因素(如閾值的可能性)、建模影響的嚴重性以及劑量一效應曲線的斜率等均可能影響不確定性係數的選擇和大小。
 圖1
圖1 圖2
圖2
