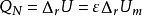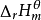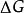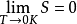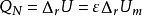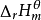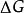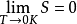簡介,核心問題,基本概念,功和熱,化學反應熱效應,標準摩爾生成焓,標準摩爾熵,吉布斯自由能,標準摩爾生成吉布斯自由能,重要定理髮展介紹,Hess定律,熱力學第一定律,Carnot定理,熱力學第二定律,熱力學第三定律,重要研究領域,
簡介
化學熱力學的主要理論基礎是經典熱力學。19世紀上半葉,作為物理學的巨大成果,“能”的概念出現了;人們逐漸認識到熱只是能的多種可互相轉換的形式之一,科學家意識到了統治科學界百年之久的“熱質說”是錯誤的,於是
熱力學應運而生。19世紀中葉,人們在研究熱和功轉換的基礎上,總結出熱力學第一定律和熱力學第二定律,解決了熱能和機械能轉換中在量上的守恆和質上的差異。1873 ~1878年,吉布斯(Josiah Willard Gibbs,1839—1903) 進一步總結出描述物質系統平衡的熱力學函式間的關係,並提出了相律。20世紀初,能斯特(Walther Hermann Nernst,1864—1941)提出了熱定理,使“
絕對熵”的測定成為可能。為了運用熱力學函式處理實際非理想系統,1907年,
路易斯(Gilbert NewtonLewis,1875—1946)提出了
逸度和
活度的概念。至此,經典熱力學建立起完整的體系。
核心問題
化學熱力學是建立在熱力學三大定律基礎上,從三大定律出發,用數學方法加以演繹推論,就可得到描寫物質體系平衡的熱力學函式及函式間的相互關係,再結合必要的化學數據,解決化學變化、物理變化的方向和限度,這也是化學熱力學的內容和方法。化學熱力學的核心問題是:
①所有的物質都具有能量,能量是守恆的,各種能量是可以互相轉換的;
②事物總是自發地趨向於平衡狀態;
③處於平衡狀態的物質系統可用幾個可觀測量描述。
特別是熱力學第三定律提出,為化學平衡提供了根本性原理,例如吉布斯給出了熱力學原理更為完美的表述形式,用
焓、
熵等幾個熱力學函式來描述系統的狀態,使化學變化和物理變化的描述更為方便和實用。到20世紀60年代,人們開始對遠離平衡的非平衡狀態和過程的研究後,使化學熱力學取得更大的進展。
基本概念
功和熱
功和
熱(Q 和 W)是在化學學習過程中碰到的唯一一組非狀態函式的函式,他們屬於過程函式,是在狀態變化的過程中所產生,其數值大小跟狀態函式不同,主要跟狀態變化所經歷的具體過程和途徑有關,相同的始態和終態,若所走途徑不一樣,其所對應的功和熱可能也不一樣,而狀態函式的變化值只與始態以及終態有關。此處強調功和熱的產生是由於狀態變化而導致的,其數值和某個狀態無關,如:物體的溫度越高,則含的熱量越多。
化學反應熱效應
化學反應熱效應定義:當生成物和反應物溫度相同時,化學反應過程中吸收或放出的熱量。化學反應若是等溫等壓且不做非體積功的前提下進行,通過熱力學第一定律的推導,Q
P=△rH ,r 為英文單詞“react”,為化學反應,這裡僅僅是要與其他狀態變化原因區分開,強調狀態變化的原因是由於化學反應導致的焓變。若反應進度為 1mol時,△rH 可以寫為△rHm。由此可以看出△rHm的大小與反應進度有關,也即與化學反應方程式的書寫有關。若化學反應在等溫等容且不做非體積功的前提下進行,則熱效應通過熱力學第一定律的推導為
,同理,△rUm的大小也與方程式的書寫有關。這裡與反應進度有關的一切物理量都與方程式的書寫有關。
標準摩爾生成焓
標準摩爾生成焓(
)定義:在一定的溫度(通常是 298.15K) 時,標準狀態下由指定元素的最穩定單質生成 1mol 某物質時的焓變稱為該物質的標準摩爾生成焓,簡稱標準生成焓。
標準摩爾熵
化學反應的方向與兩個因素有關,一是能量因素,二是混亂度因素,而熵即為混亂度的量度。混亂度大,則體系的能量大,也即熵大。化學反應方向是這兩者共同作用的結果。若用Ω表示體系擁有的微觀排列總數,則由統計力學可以證明 S=klnΩ。該式稱為玻爾茲曼關係式。它表明,處於一定巨觀狀態的系統所擁有的微觀狀態數愈多,則系統的混亂度愈大,熵值愈高。在絕對零度(0 K)時,純淨完美的晶體的排列是整齊有序的,這種微觀狀態數為 1(Ω=1)。所以,熱力學規定:0K 時,任何純淨完美的晶體的熵值等於零(S0=0)。以此為基準,某物質在溫度 T 時的熵值稱為該物質在溫度 T 時的絕對熵(ST)。某物質從 0K 升溫到 TK 時的熵變 S 就等於該物質在 T度時的絕對熵。與標準摩爾生成焓不同,熵是絕對值。
吉布斯自由能
按照國際純粹與套用化學聯合會( IUPAC ) 的定義,吉布斯自由能是焓( H )減去熱力學溫度(T)和熵(S)的乘積,即 G = H -TS ,常稱為自由能。其單位為焦耳( J )或為千焦(KJ)。G 同 H 一樣,是複合狀態函式,也具有狀態函式的屬性。由於 H 絕對值未知故 G 的絕對值也是不可知的,但其變化量即
只決定於系統的始態和終態,而與變化的具體途徑無關。經過熱力學推導
的正負值直接決定了過程變化的方向。
標準摩爾生成吉布斯自由能
標準摩爾生成吉布斯自由能(
)是指:在標準狀態下,由指定元素單質生成 1mol純物質時反應的吉布斯自由能變化,稱為該物質的標準摩爾吉布斯生成自由能,簡稱標準吉布斯生成自由能。單位是 J·mol
-1或 kJ·mol
-1。此物理量的定義與標準摩爾生成焓的定義相似,所表達的意義也相同,可以推導出同樣的結論,即:指定元素最穩定單質的標準摩爾生成吉布斯自由能數值為零,事實上絕對值不為零。所以標準摩爾生成吉布斯自由能實驗數據都是相對於元素最穩定單質而來的,是一個相對值。
重要定理髮展介紹
Hess定律
Hess定律俄國的赫斯(Germain Henri Hess,1802—1850) 很早就從化學研究中領悟了一些能量守恆的思想。1836年,赫斯向彼得堡科學院報告:“經過連續的研究,我確信,不管用什麼方式完成化合,由此發出的熱總是恆定的,這個原理是如此之明顯,以至於如果我不認為已經被證明,也可以不假思索就認為它是一條公理。”此後,赫斯從各方面對上述原理進行了實驗驗證,並於1840年提出了著名的Hess定律:“當組成任何一種化學化合物時,往往會同時放出熱量,這熱量不取決於化合是直接進行還是經過幾步反應間接進行”。
熱力學第一定律
1850年,科學界已經公認能量守恆是自然界的普遍規律。對能量守恆與轉化定律做出明確敘述的、貢獻突出的科學家主要有德國的梅耶爾(Julis Robert Mayer,1814—1878)、赫姆霍茲(Hermann VonHelmholtz,1821—1894) 和英國的焦耳(James Perscott Joule,1818—1889)。梅耶爾是第一個完整提出能量守恆與轉化原理的人,他在1842年發表的題為《熱的力學的幾點說明》一文中,宣布熱和機械能的相當性和可轉化性。但在論文發表的最初幾年,他的著作不僅沒有得到科學界的重視,反而受到一些著名物理學家的反對。
德國的赫姆霍茲是第一個從多方面論證能量守恆與轉化定律的科學家。1847年,他完成了著名的論文《力的守恆》,在文中他充分論述了能量轉化與守恆這一命題。不過他的這篇論文被認為是思辨性的、缺乏實驗依據。焦耳是英國著名的實驗物理學家,他從1843年開始以磁電機為對象測量熱功當量,直到1878年最後一次發表實驗結果,先後做實驗不下400餘次,採用了原理不同的各種方法,他所獲得的日益精確的實驗數據,為熱和功的相當性提供了可靠的證據,使能量守恆與轉化定律建立在牢固的實驗基礎之上。1850年,德國的克勞修斯(Rudoff Julius Emanuel Clausius,1822—1888) 首先提出了完整的熱力學第一定律的數學形式。他全面分析了熱量Q、功W和氣體狀態的某一特定函式u之間的聯繫,考慮一無限小的過程,列出全微分方程為δQ= du+AδW。這裡的u後來被人們稱作內能或熱力學能,A是熱功當量,W是外功。克勞修斯雖然沒有使用能量一詞,但實際上已經為熱力學第一定律奠定了基礎。熱力學第一定律是能量守恆與轉化定律在熱現象領域所具有的特殊形式。
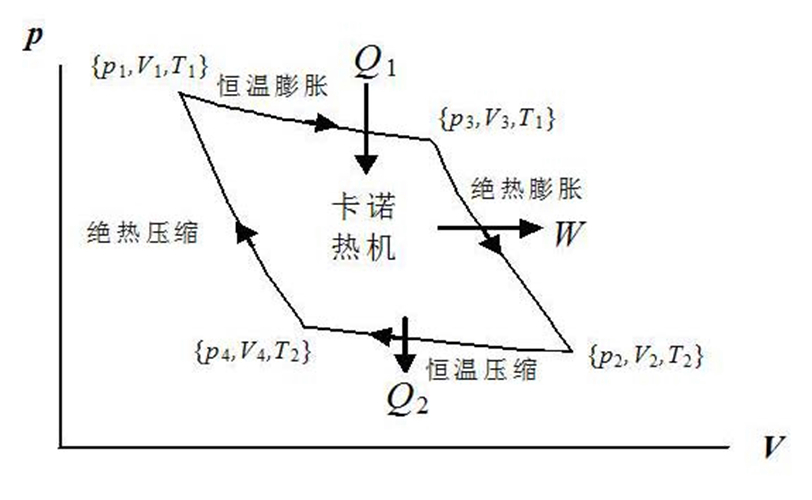
Carnot定理
蒸汽機於18世紀被發明,又分別在1765年和1782年經過瓦特(James Watt,1736—1819) 的兩次改進,使蒸汽機的套用得到了很大的發展,但其效率仍然不高。如何進一步提高蒸汽機的效率以及效率的極限值成為當時工程師和科學家共同關心的問題。法國數學家和工程學家卡諾(Sadi Carnot,1796—1832) 研究了這類問題。1824年,卡諾發表了著名的論文《關於火的動力及適於發展這一動力的機器的思考》,提出了在熱機理論中有重要地位的卡諾定理,這個定理實際上是熱力學第二定律的先導。卡諾取一個理想循環( 又稱卡諾循環) ,由此建立了熱量與其轉移過程中所做功的理論聯繫,得到了一個普遍的結論:“熱的動力與用於實現動力的工作物質無關; 動力的量唯一地取決於熱質在其間轉移的兩物體的溫度。”該結論被稱為卡諾定理。由卡諾定理可以算出熱機能夠達到的最高效率。
熱力學第二定律
卡諾定理被提出後,許多科學家都開始對其進行研究。1850年,克勞修斯在《物理學與化學年鑑》上率先發表了題為《論熱的動力及由此推出的關於熱本性的定律》的論文,對卡諾定理做了詳盡的分析。在這篇論文中,克勞修斯正確地對卡諾定理作了揚棄。1854年,克勞修斯發表了另一篇題為《熱的機械論中第二個基本理論的另一形式》的論文。在這篇論文中,克勞修斯更加明確地闡明:“如果沒有與之聯繫的、同時發生的其他變化的話,熱永遠不能從冷的物體傳向熱的物體。關於兩個不同溫度的物體間熱交換的種種已知事實證明了這一點; 因為熱處處都顯示企圖使溫度的差別均衡之趨勢,所以只能沿相反的方向,即從熱的物體傳向冷的物體。因此,不必再作解釋,這一原理的正確性也是不證自明的。”與此同時,開爾文(Lord Kelvin,即William Thomson,1824—1907) 也在這方面進行研究。1851年,他在《愛丁堡皇家學會會刊》上發表了3篇論文,題目都是《熱的動力理論》。在文中,他提出了一條公理:“利用無生命的物質結構,把物質的任何部分冷到比周圍最冷的物體還要低的溫度以產生機械效應,是不可能的。”其實,克勞修斯所用的公理和開爾文所提出的公理是相通的,克勞修斯的說法和開爾文的說法是等價的。至此,熱力學第二定律與熱力學第一定律一起,組成了熱力學的理論基礎。
熱力學第三定律
人們根據大量的低溫研究實驗總結出了熱力學第三定律。早在1848年,開爾文在確定絕對溫標的時候,就對絕對零度作了說明。1902年,美國人理查茲(Theodore William Richards,1868—1926) 在研究幾種原電池的電動勢與溫度的關係時,發現溫度越低,同一電池反應的ΔrGm與ΔrHm之值越接近,但他未能認識到此結果的重要性。1906年,德國物理學家能斯特系統地研究了低溫下凝聚系統的化學反應,提出了一個假設和相應的理論,稱為能斯特熱定理,並據此得出推論:“在低溫下,任何物質的比熱都要趨向某個很小的確定值,這個值與凝聚態的性質無關。”後來,能斯特通過實驗證明這個很小的確定值就是零,這與愛因斯坦的量子熱容理論一致。1912年,普朗克(Max Planck,1858—1947) 把能斯特熱定理推進了一步;他假定在0K時,純凝聚態的熵值等於0,即
。1923年,路易斯和蘭道爾(Max Randall) 給出了令人滿意的熱力學第三定律的表述:“若將絕對零度時完美晶體中的每種元素的熵值取為0,則一切物質均具有一定的正熵值; 但是,在絕對零度時,完美晶體物質的熵值為0”。1927年,西蒙(F. Simon,1893—1956) 對熱力學第三定律作了改進和推廣:在0K下,對於內部已達到熱力學平衡的系統,其所有狀態間的熵差都等於0。熱力學第三定律“架設了從經典理論通向量子理論的橋樑”。
重要研究領域
近年來,伴隨著國家經濟的騰飛和科學技術的發展,我國化學熱力學取得了長足的進步和發展。化學熱力學的重要研究領域主要體現在化學熱力學與環境、材料、生命等其他前沿學科的交叉,包括:
(1)綠色化學中的熱力學,綠色化學是近十年才形成和發展起來的一門新興學科,它以可持續發展為目標,涉及有機合成、催化、生物化學、分析化學等學科,內容廣泛。化學熱力學研究是綠色化學研究的重要內容之一。
(2)材料熱力學,其力圖套用熱力學的基本原理來闡明材料科學中的各種熱力學現象,對於材料的設計和套用具有重要的指導意義。
(3)生物熱力學,它利用化學熱力學的原理和方法研究生命過程的重要現象,以期揭示生命現象的本質並從理論上尋求根據。在許多情況下是其他研究方法和手段所不能代替的。
(4)膠體化學熱力學,膠體化學內涵廣泛,具有非常強烈的實用性,而且與其他多學科相互交叉,用熱力學原理和方法研究膠體體系的重要現象和過程,對於促進膠體化學的理論發展和膠體體系的套用具有重要的意義。
(5)超分子體系中分子識別熱力學,大環受體分子識別熱力學研究可為構築新型功能超分子體系,解決生命科學、材料科學和分離科學等重要領域中的許多關鍵問題提供重要的信息。
(6) 新型熱分析實驗方法和儀器,熱分析是化學熱力學研究最常用的手段之一,滲透到化學的各個學科,具有廣泛的套用性,新型熱分析實驗方法和技術的研發在環境科學、材料科學、生命科學、能源、醫療衛生中發揮著重要的作用。