背景及簡介
第一,是如何保存生物分子生活狀態的結構。 在這方面早期的乾燥樣品的金屬投影或負染的方法顯然不符合要求。這是因為乾燥過程本身會改變分子的形態,用於增加反差的
重金屬會掩蓋分子的結構細節。冷凍 電鏡方法的出現,使得這些問題得到了解決。冷凍電鏡方法是在上個世紀 80 年代提出的,經過近 20 年的努力,現正趨於成熟。由於冷凍電鏡樣品的特殊製備方法,使生物樣品可以在含水狀態下在電鏡內觀察,所得結果更接近生活狀態。不僅如此,由於冷凍過程可以在數毫秒內完成,因而可以用電鏡方法撲捉那些瞬間即逝的生化過程,在
亞細胞和分子水平上把結構和功能更好的結合起來。
第二,在電鏡下觀察生物大分子時,觀察的對象是三維結構,而電鏡圖像是這些三維結構的二維投影。因 此必須解決由生物分子的二維電鏡圖像推知其三維結構的方法問題,這就是三維重構方法。在過去的10年間,特別是最近5年來三維重構方法取得了重大進展。這首先要歸因於電鏡設備本身的進步。計算機輔助的電鏡控制系統的出現使樣品台傾斜角度,欠焦量以及曝光量等的精確調節和控制成為可能。其次,計算機圖像處理技術的進步不僅稱補了電鏡方法固有的缺陷,而且使以前看似不可能的樣品的分析成為現實。
冷凍電鏡方法結合三維重構技術近年來在結構生物學領域發展迅速並正在取得重要突破。與
X射線晶體學和
核磁共振波譜學(NMR) 等傳統的測定蛋白質分子三維結構的方法相比較, 它具有以下幾個方面的優勢:
1) 保持生物樣品的活性和功能狀態;
2) 無須製備晶體, 特別適合難於結晶的大分子及其複合物的三維結構判定;
3) 結合新型的電子顯微鏡、制樣機器人等設備和技術, 可以實現顯微制樣、數據收集、三維重構全過程的自動化或半自動化, 為高通量、快速解析大分子及其複合物的三維結構打下基礎。
三維重構主要方法
利用冷凍電鏡技術進行三維重構的主要方法有: 單顆粒分析(single particle analysis,SPA) 方法, 電子晶體學(electron crystallography) 方法, 和電子斷層成像(electron tomography, ET) 方法。其中電子晶體學方法較多用於一些膜蛋白結構的解析, 其解析的結構可以達到很高的解析度, 但要得到蛋白的二維晶體仍然是一個非常具有挑戰性的工作。
單顆粒分析方法
單顆粒分析方法適用於具有結構同一性的樣品, 通過採集大量單個顆粒的二維投影圖來重構三維結構,是冷凍電鏡三維重構發展最快也是最主要的結構解析方法。利用單顆粒電鏡重構技術已經解析出了很多生物大分子、病毒以及複合物的結構, 目前的最新研究成果已經可以在準原子或原子解析度下解析具有高度對稱性的病毒分子結構, 最高精度已經達到約3.3A左右。在準原子解析度下, 許多結構上的細節都清晰呈現, 並使得建立基於冷凍、電鏡密度圖的獨立原子模型(de novo modelling) 成為可能。對於不具有對稱性的大分子複合體, 其結構解析的解析度也在迅速提高。另外, 利用單顆粒分析方法解析各種重要功能的分子機器(molecular machine) 在不同功能狀態下的結構, 以及利用其進行重建結果的多變數統計分析以確定生物大分子複合物不同的構象與結構異性也是目前研究的熱點。
電子斷層成像
電子斷層成像通過獲取同一區域多個角度的投影圖來反向重構所研究對象的三維結構,適合於在納米級尺度上研究不具有結構均一性的蛋白、病毒、細胞器以及它們之間組成的複合體的三維結構。與蛋白質電子晶體學和單顆粒技術相比, 這種技術無需樣品顆粒具有結構同一性, 也不強調樣品具有一定的對稱性。因此, 雖然目前電子斷層成像所獲得的結構的解析度(約4~10 納米) 不能與以上兩種技術相比, 但其在研究非定形、不對稱和不具全同性的生物樣品的三維結構和功能中有著不可替代的重要作用。
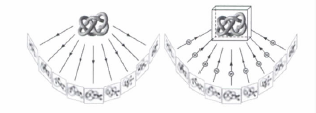 電子斷層掃描技術
電子斷層掃描技術 樣品製備
用於冷凍電鏡研究的生物大分子樣品必須十分純淨。冷凍電鏡樣品製備就是在親水的支持膜上將冷凍的含水樣品包埋在一層較樣品略高的薄冰內的過程。
冷凍樣品向電鏡內的轉移
將冷凍樣品轉移到電鏡內的過程中需要注意,既不能使樣品解凍,又不應在樣品表面結霜。為此,需要用專門的設備—冷凍
輸送器,來完成這一步驟。
冷凍樣品在電鏡下的觀察和拍照
圖像三維重構
在電子顯微鏡中,由於場深很大,被觀測物體不同層面可同時被聚焦在像平面上。這決定了電子顯微圖像不是物體的三維圖像,而是物體三維圖像在垂直於電子束方向的一個二維投影,對於薄樣品,其電子顯微像的強度與樣品中的原子勢場分布的投影成正比。因此,電子顯微圖像可以直接地表示物體的原子勢場分布,從而 反映物體的原子密度分布的投影。因而電子顯微圖像就是把三維空間的密度結構信息壓縮在一個二維投影 平面上。如何從二維投影獲得三維結構,要套用三維重構原理。 目前,三維重構都基於數學中的一個定理一 中心截面定理。三維空間密度分布函式的投影的
傅立葉變換相當於同一三維空間密度分布函式的傅立葉變換在垂直於投影方向的中心截面。
套用這一定理,如果我們能獲得物體的二維結構的傅立葉變換的沿不同方問 的中心截面並把他們在二維倒易空間中合併起來,獲得整個物體二維結構在倒易空間的三維傅立葉函式 ,我們就可將此函式進行逆傅立葉變換,從而獲得整個物體的三維結構。
冷凍電子顯微學技術在現代生物學中的套用
研究不適合於套用X射線晶體學和核磁共振波譜學的分子及其聚合物的結構
Alzhiemer 疾病的澱粉狀蛋白纖維聚合物的結構:研究表明這些澱粉狀蛋白纖維聚合物是由腦組織內的Aβ蛋白聚合而成,由於這種聚合物不能形成結晶,不能用X射線晶體學測定其結構,又由於這種聚合物的低溶解性和纖維狀結構,亦不能用NMR測定其結構。這種纖維聚合物恰恰是冷凍電子顯微鏡研究的理想對象。
研究生物大分子處於不同功能狀態時的結構
離子通道開關的機制:離子通道在生物學功能中起關鍵性作用,如信息傳遞,神經傳導,研究離子通道的結構對理解生物學功能及基於功能的藥物設計是具有重要意義的。由於離子通道開放的時間很短(由毫微秒到毫秒),很難用X射線晶體學來研究其結構。套用冷凍電鏡技術,可將分子凍結在不同的功能狀態,因而可研究這些不同狀態的結構。
為X射線晶體學結構解析提供初始分子置換模型及初始相位
核糖體的三維結構:解析
核糖體的三維結構對於理解蛋白質的合成機制有著重大意義,結構生物學家為此奮鬥了三十多年,1999年H.F.Nollor研究組利用冷凍電鏡獲得了低分辨核糖體結構,並將其作為分子置換模型,將核糖體的基本組分在三維結構中進行了精確定位,為闡明蛋白質的合成打下了結構基礎。如果沒有冷凍電鏡提供的低分辨結構作為初始模型,核糖體三維結構的解析就不會有重大突破。
研究生物大分子複合物的結構
病毒-受體複合物的結構
冷凍電鏡技術的套用前景
隨生物成像技術的發展,電鏡技術已不再限於單純的形態結構研究,而發展為不同水平上的顯微學技術綜合套用。同時,顯微學技術與細胞生物學、分子生物學等其他生命科學技術的結合套用正在成為研究熱點。例如,
免疫細胞化學與電鏡技術相結合,使
原位雜交技術已從理論走向實際,得到相當普遍的套用。因此,冷凍電鏡技術在對物質細微結構與功能的分析上必將極大地推動生物醫學的發展。
 電子斷層掃描技術
電子斷層掃描技術
 電子斷層掃描技術
電子斷層掃描技術