定義
免疫組織化學(Immunohistochemistry,IHC)是利用抗原與抗體特異性結合的原理,通過化學反應使標記抗體的顯色劑(螢光素、酶、金屬離子、同位素)顯色來確定組織細胞內抗原(多肽和蛋白質),對其進行定位、定性及定量的研究,稱為免疫組織化學。
主要過程
免疫組織化學的全過程包括:
 免疫組織化學相關圖書
免疫組織化學相關圖書1.抗原的提取與純化;
2.免疫動物或細胞融合,製備特異性抗體(免疫球蛋白)以及抗體的純化;
4.標本的製備;
6.觀察結果。
套用基本原則
免疫組織化學染色在生物醫學研究中具有十分廣泛的作用。並且
涉及許多研究領域。但是,免疫組織化學技術也有其局限性,例如,組織細胞內的待測物質要有抗原性,而且需要有一定濃度方可檢出;檢出的免疫反應陽性蛋白不能被確定是細胞新合成的蛋白還是通過細胞間運輸而來的蛋白,因此,在實驗設計中應充分考慮這些特點。如果實驗需要證明已知蛋白為何種細胞合成,需採用
分子原位雜交技術解決。為引導初學者在實驗設計中合理巧妙地運用免疫組織化學技術,將其套用的基本原則簡述如下:
1.確定細胞類型和形態。組織細胞內有些蛋白具有
組織特異性,如膠質原纖維酸性蛋白(gial fibrillary acidic protein,GFAP)只存在於
星形膠質細胞內.
神經絲蛋白(Neurofilament,NF)只存在於神經細胞內。通常把這些具有組織特異性的蛋白稱為標記性蛋白(Proteiniliaker)。通過標記性蛋白的特異性抗體可確定細胞種類。有些細胞(如
表皮內朗格漢斯細胞和黑色素細胞等)在光鏡下不易辨認,通過對胞質內的特定蛋白實施免疫組化染色,便能清楚顯示此類細胞外形輪廓。這種作用在
神經科學研究和腫瘤臨床病理中顯得尤為重要。
2.辨認
細胞產物的來源。利用某些細胞產物為抗原,製備相應的抗體,對組織細胞實施免疫組織化學染色,以確定細胞產物的來源。如內分泌細胞產生的各種激素,大多數可用免疫組化染色技術辨認,據此可研究細胞的分泌功能及對內分泌腫瘤作功能分類,檢測分泌異位激素的腫瘤等,了解細胞分化程度。
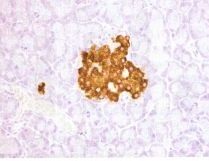 免疫組織化學染色法(DAB顯色)
免疫組織化學染色法(DAB顯色)3.確定
細胞的分化程度。不同的同一類細胞多表達不同的標誌性蛋白,根據對這些不同蛋白的鑑定可確定細胞的分化程度。例如,神經上皮細胞的標誌性蛋白是
巢蛋白(
nestin),當其分化為
放射狀膠質細胞時表達
波形蛋白(vimentin)。在神經元發生期分化為成神經細胞時則表達Ⅲβ神經
微管蛋白(TUJl),成神經細胞分化為成熟的神經元時表達
神經絲蛋白(neurofilament,NF)。
4.追蹤神經纖維束和它的投射區。用於此目的的免疫組織化學方法常與
軸漿運輸示蹤法相結合來研究神經元之間的聯繫。軸漿運輸示蹤法是利用某些物質可被神經末梢攝取。經軸質逆行運輸到胞體的特點.用組織化學方法顯示出神經元的輪廓。常用
示蹤劑有辣根過氧化物酶和螢光金等。例如。為觀察周圍神經系統或中樞神經系統某核團神經纖維投射.先將示蹤劑注射到動物神經纖維末梢部位,使動物存活一段時間,在預期神經纖維投射部位取材,先通過組織化學方法使示蹤劑定位,再實施免疫組織化學方法確定其性質。
5.在臨床病理中的套用。如鑑定病變性質,發現微小病灶,探討腫瘤起源或分化表型,確定腫瘤分期,指導治療和預後。輔助疾病診斷和分類,尋找感染病因等。
相關操作
儀器設備
1)18cm不鏽鋼高壓鍋或電爐或醫用微波爐;
2)水浴鍋
試劑
1)PBS緩衝液(pH7.2~7.4):NaCl 137mmol/L,KCl 2.7mmol/L,Na2HPO4 4.3mmol/L, KH2PO4 1.4mmol/L。
2)0.01mol/L檸檬酸鹽
緩衝液(CB,pH6.0,1000ml):檸檬酸三鈉 3g,檸檬酸 0.4g。
3)0.5mol/L EDTA緩衝液(pH8.0):700ml水中溶解186.1gEDTA·2H2O,用10 mmol/L NaOH調至pH8.0,加水至1000ml。
4)1mol/L的TBS緩衝液(pH8.0):在800ml水中溶解121gTris鹼,用1N的HCl調至pH8.0,加水至1000ml。
5)酶消化液: a、0.1%胰蛋白酶液:用0.1%CaCl2(pH7.8) 配製。 b、0.4%胃蛋白酶液:用0.1N的HCl配製。
6)3%甲醇-H2O2溶液:用30%H2O2和80%甲醇溶液配製。
7)封裱劑:
a、甘油和0.5mmol/L碳酸鹽緩衝液(pH9.0~9.5)等量混合;
b、油和TBS(或PBS)配製。
8)TBS/PBS pH9.0~9.5,適用於螢光顯微鏡標本;pH7.0~7.4適合於光學顯微鏡標本。
操作流程
1、脫蠟和水化
脫蠟前,應將組織晶片在室溫中放置60分鐘或60℃恆溫箱中烘烤20分鐘。
1)組織晶片置於二甲苯中浸泡10分鐘,更換二甲苯後再浸泡10分鐘;
2)無水乙醇中浸泡5分鐘;
3)95%乙醇中浸泡5分鐘;
4)70%乙醇中浸泡5分鐘;
用於福馬林固定的石蠟包埋組織晶片。
1)抗原熱修復
(1)高壓熱修復 在沸水中加入EDTA(pH8.0)或0.01M枸櫞酸鈉
緩衝溶液(pH6.0)。蓋上不鏽鋼高壓鍋的蓋子,但不進行鎖定。將玻片置於金屬染色架上,緩慢加壓,使玻片在
緩衝液中浸泡5分鐘,然後將蓋子鎖定,小閥門將會升起來。10分鐘後,去除熱源,置入涼水中,當小閥門沉下去後打開蓋子。本方法適用於較難檢測或核抗原的抗原修復。
(2)煮沸熱修復 電爐或者水浴鍋加熱0.01M枸櫞酸鈉緩衝溶液(pH6.0)至95℃左右,放入組織晶片加熱10~15分鐘。
(3)微波熱修復 在微波爐里加熱0.01M枸櫞酸鈉緩衝溶液(pH6.0)至沸騰後將組織晶片放入,斷電,間隔5~10分鐘,反覆1-2次。適用的抗原有:AR,Bax,Bcl-2,C-fos,X-jun,C-kit,C-myc,E-cadherin,Chromogranin A,Cyclin,ER,Heat shock protein,HPV,Ki-67,MDMZ,p53,p34,p16,p15,P-glycoprotein,PKC,PR,PCNA,ras,Rb,TopoismeraseⅡ等。
2)酶消化方法 常用0.1%
胰蛋白酶和0.4%胃蛋白酶液。胰蛋白酶使用前預熱至37℃,切片也預熱至37℃,消化時間約為5~30分鐘;胃蛋白酶消化37℃時間為30分鐘。適用於被固定遮避的抗原,其中有:Collagen,Complement,Cytokeratin,C-erB-2,GFAP,LCA,LN等。
3、免疫組織化學染色
SP法
2)PBS洗2~3次各5分鐘;
3)3%H2O2(80%甲醇)滴加在TMA上,室溫靜置10分鐘;
4)PBS洗2~3次各5分鐘;
5)抗原修復;
6)PBS洗2~3次各5分鐘;
7)滴加正常山羊血清封閉液,室溫20分鐘。甩去多餘液體。
8)滴加Ⅰ抗50μl,室溫靜置1小時或者4℃過夜或者37℃1小時。
9)4℃過夜後需在37℃復溫45分鐘。
10)PBS洗3次各5分鐘;
11)滴加Ⅱ抗40~50μl,室溫靜置,或37℃1小時;
12)II抗中可加入0.05%的tween-20。
13)PBS洗3次各5分鐘;
14)DAB顯色5~10分鐘,在顯微鏡下掌握染色程度;
15)PBS或自來水沖洗10分鐘;
17)自來水沖洗10~15分鐘;
18)脫水、透明、封片、鏡檢。
SABC法
1)脫蠟、水化。
2)PBS洗兩次各5分鐘。
3)用蒸餾水或PBS配置新鮮的3%H2O2,室溫封閉5~10分鐘,蒸餾水洗3次。
4)抗原修復。
5)PBS洗5分鐘。
6)滴加正常山羊血清封閉液,室溫20分鐘。甩去多餘液體。
7)滴加Ⅰ抗,室溫1小時或者4℃過夜或者37℃1小時(4℃過夜後在37℃復溫45分鐘)。
8)PBS洗三次每次2分鐘。
9)滴加生物素化二抗,20℃~37℃20分鐘。
10)PBS洗3次每次2分鐘。
12)PBS洗4次每次5分鐘。
13)DAB顯色:DAB顯色試劑盒或者自配
顯色劑顯色(鏡下掌握顯色程度)。
15)脫水、透明、封片、鏡檢。
常見問題
免疫組化實驗所用的抗體
免疫組化實驗中常用的抗體為
單克隆抗體和多克隆抗體。單克隆抗體是一個B淋巴細胞克隆分泌的抗體,套用細胞融合
雜交瘤技術免疫動物製備。多克隆抗體是將純化後的抗原直接免疫動物後,從動物血中所獲得的免疫血清,是多個B淋巴細胞克隆所產生的抗體混合物。
免疫組化實驗所用的組織和細胞標本
實驗所用主要為組織標本和細胞標本兩大類,前者包括
石蠟切片(病理大片和組織晶片)和冰凍切片,後者包括組織印片、細胞爬片和細胞塗片。其中石蠟切片是製作組織標本最常用、最基本的方法,對於組織形態保存好,且能作
連續切片,有利於各種染色對照觀察;還能長期存檔,供回顧性研究;石蠟切片製作過程對組織內抗原暴露有一定的影響,但可進行抗原修復,是免疫組化中首選的組織標本製作方法。
石蠟切片的抗原修復及方法
石蠟切片標本均用甲醛固定,使得細胞內抗原形成醛鍵、羧甲鍵而被封閉了部分
抗原決定簇,同時蛋白之間發生交聯而使抗原決定簇隱蔽。所以要求在進行IHC染色時,需要先進行抗原修復或暴露,即將固定時分子之間所形成的
交聯破壞,而恢復抗原的原有空間形態。
常用的抗原修複方法有微波修復法,高壓
加熱法,酶消化法,水煮加熱法等,常用的修復液是pH6.0的0.01 mol/L的檸檬酸鹽緩衝液。
常用染色方法
根據
標記物的不同分為免疫螢光法,免疫酶標法,親和組織化學法,後者是以一種物質對某種組織成分具有高度
親合力為基礎的檢測方法。這種方法敏感性更高,有利於微量抗原(抗體)在細胞或
亞細胞水平的定位,其中生物素——抗生物素染色法最常用。
抗體反應
交叉反應原因
指抗體除與其相應的抗原發生特異性反應外還與其它抗原發生反應。產生的原因有以下幾個方面:
1. 抗原特異性指用於免疫動物的抗原性物質中含有多種抗原分子,它引起動物產生針對多種抗原分子特異性的相應抗體。任何其它物質只要含有一種或多種與上述物質相同的抗原分子,必將與上述多特異性的抗血清發生交叉反應。
2. 共同決定簇即兩種抗原分子中都含有相同的
抗原決定簇。
3. 決定簇相似,兩種不同的抗原決定簇,如果結構大致相同,由於空間構象關係,某一決定簇的相應抗體可以與大致相同的決定簇發生交叉反應。當然抗原一抗體之間構象相似時的結合力小於吻合時的結合力。
多抗和單抗特性比較
1.均一性。一種單抗中,每個抗體的化學結構和胺基酸順序都相同,只有一種Ig亞類。即單抗是一種純度很高的均一抗體。而從不同動物,不同時期所得到的多抗,各有不同的化學組成。多抗是多種種類和亞類Ig的混合物。
2. 穩定性。單抗的穩定較差,對PH變化敏感,對熱不穩定,提純過程中易變性,而多抗的穩定性則較好。
3.
特異性。單抗是單一地針對抗原的某一決定簇,所以用它進行血清學反應時,特異性強,敏感性高,一般不發生交叉反應。而多抗能與抗原上的多種
抗原決定簇結合,所以特異性較差,較易引起交叉反應。
4.重複性。單抗的重複性好,而多抗每批都不一樣。
5. 沉澱反應。多抗由於與抗原多價結合容易形成網路樣沉澱,而單抗只與抗原結合產生二聚體,不能直接形成抗原抗體沉澱物。
抗體保存
抗體儲存容器應由不吸附蛋白質的材料製成,常用的有
聚丙烯,聚碳酸酯和硼矽酸玻璃。如儲存的抗體中蛋白濃度很低(10-100mg/L),就應另加隔離蛋白以減少容器對抗體蛋白的吸附,隔離蛋白常用0.1%-1.0%的
牛血清白蛋白。絕大多數已稀釋的抗體應存在4℃-8℃條件下,以免凍融對抗體蛋白產生有害效應。
抗體原液和已分離的免疫球蛋白組分應保存於-20℃條件下,並避免反覆凍融。冷凍的抗體溶液應置於室溫中緩慢地解凍,應絕對避免用高溫快速解凍。被細菌污染的抗體常會出現假陽性結果,應將污染的抗體溶液及其他試劑棄之。為防止細菌污染,可於抗體溶液中加入0.01%
疊氮鈉。
抗體經真空冷凍乾燥後置-20℃以下可保存3-5年。保存稀釋後的單抗應加入0.1%疊氮鈉濃度。大多數稀釋抗體可進行
冷凍保存,少數抗體可能會丟失抗原活性。大多數單抗,只要蛋白濃度適當,可在4℃下保存數月。
 免疫組織化學相關圖書
免疫組織化學相關圖書 免疫組織化學染色法(DAB顯色)
免疫組織化學染色法(DAB顯色)
 免疫組織化學相關圖書
免疫組織化學相關圖書 免疫組織化學染色法(DAB顯色)
免疫組織化學染色法(DAB顯色)