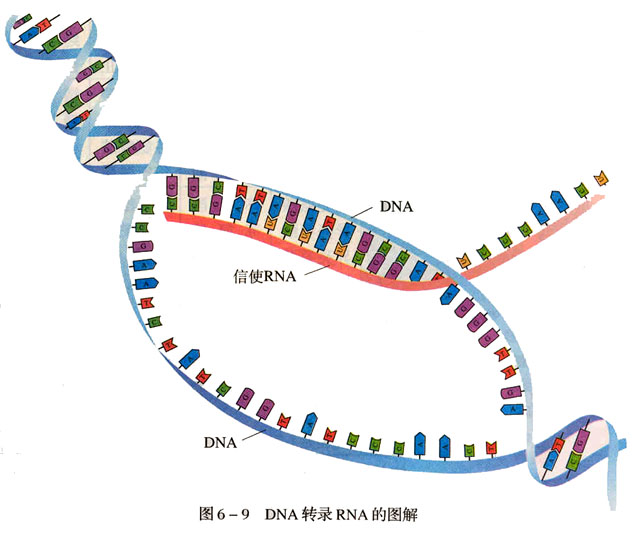
物質簡介 信使核糖核酸
信使RNA是指導
蛋白質生物合成 的直接模板。mRNA 占細胞內RNA總量的2%~ 5%,種類繁多,其
分子大小 差別非常大。
如在DNA中一樣,mRNA遺傳信息也保存在
核苷酸序列 中,其被排列成由每個三個
鹼基對 組成的
密碼子 。每個密碼子編碼特定胺基酸,但
終止密碼子 例外,因為其終止蛋白質合成。
信使RNA
將密碼子翻譯成胺基酸的過程需要另外兩種類型的RNA:轉移RNA(
tRNA )和
核糖體RNA (rRNA)。tRNA介導密碼子的識別並提供相應的胺基酸,rRNA是
核糖體蛋白質 製造機械的核心組成部分。
mRNA的存在首先由
Jacques Monod 和FrançoisJacob提出,隨後由Jacob,Sydney Brenner和Matthew Meselson於1961年在
加州理工學院 發現。
原核生物mRNA的轉錄與翻譯一般是
偶聯 的,真核生物轉錄的mRNA前體則需經
轉錄後加工 ,加工為成熟的mRNA與
蛋白質 結合生成
信息體 後才開始工作。
原核生物mRNA
半壽期 很短,一般為幾分鐘 ,最長只有數小時(RNA
噬菌體 中的RNA除外)。真核生物mRNA的
半衰期 較長, 如胚胎中的mRNA可達數日。
原核 與
真核生物 mRNA的結構特點也不同。真核生物mRNA具有5‘帽子和3’多聚A尾巴,原核生物沒有這樣的首尾結構。
mRNA的環化
在真核生物中,由於eIF4E和poly(A)
結合蛋白 之間的相互作用,mRNA分子形成
環狀 結構,這兩種結合蛋白都與eIF4G結合,形成mRNA-蛋白-mRNA橋。環化促進核糖體在mRNA上的循環,提高翻譯效率,且確保僅有完整的mRNA得到翻譯。
合成和加工 mRNA分子的合成始於轉錄,並最終以降解結束。在被翻譯之前,真核mRNA分子通常需要大量加工和轉運,而原核mRNA分子則不需要。真核mRNA分子和它周圍的蛋白質一起被稱為信使RNA。
轉錄
轉錄是指由
DNA合成 RNA的過程。在轉錄期間,
RNA聚合酶 根據需要將一個基因的DNA拷貝成mRNA,這個過程在真核生物和原核生物中是相似的。
與原核生物明顯不同的是,真核RNA聚合酶在轉錄過程中與mRNA加工酶結合,因此,真核生物的mRNA加工可以在轉錄開始後快速進行。短壽命的未加工或部分加工的轉錄產品稱為前體mRNA或
pre-mRNA ;一旦加工完全,它被稱為成熟mRNA。
真核pre-mRNA加工
mRNA的加工在真核生物、細菌和古細菌中差異很大。實質上,非真核mRNA在轉錄時是成熟的,除極少數情況外不需要加工。然而,真核pre-mRNA需要大量加工。
5’端加帽子:5‘ 帽(也稱為RNA帽,RNA 7-甲基
鳥苷 帽或RNA m7G帽)就是一個經修飾的
鳥嘌呤核苷酸 ,在轉錄開始不久後就被添加到新產生的真核mRNA的“前”即5'末端。 5’帽由末端7-甲基鳥苷
殘基 組成,它通過5'-5'-
三磷酸 鍵與第一轉錄出的
核苷酸 連線。它的存在對於核糖體的識別和對mRNA的保護至關重要。
3’端
加尾 :是指聚
腺苷 醯基 部分與mRNA分子的
共價 連線。在真核生物中,大多數信使RNA(mRNA)分子在3'末端被
多聚腺苷酸化 。Poly A尾巴和與其結合的蛋白質有助於保護mRNA免於被
核酸外切酶 降解。3’端
加尾 對於
轉錄終止 ,從
細胞核 輸出mRNA和翻譯也很重要。 原核生物中的mRNA也常被3’端
加尾 ,但此時的poly(A)尾巴促進而不是防止核酸外切酶對mRNA的降解。
mRNA的轉運
真核生物和原核生物之間的另一個區別是mRNA的轉運。由於真核轉錄和翻譯是在不同的
細胞器 內進行的,真核mRNA必須從細胞核輸出到
細胞質 。 這一過程可能受不同
信號通路 的調節。成熟的mRNA通過其加工的修飾被識別,在結合帽
結合蛋白 CBP 20和CBP80及轉錄/輸出複合物(TREX)後通過
核孔 被輸出到細胞質。
mRNA的翻譯
因為原核mRNA不需要加工或轉運,所以原核生物mRNA在核糖體的翻譯可以在轉錄結束後立即開始。因此,可以說原核生物的mRNA翻譯與轉錄偶聯發生。
已經加工並轉運至細胞質的真核mRNA(即成熟mRNA)在核糖體的翻譯發生在細胞質中自由漂浮的核糖體中,或者通過
信號識別顆粒 導向到的
內質網 中。因此,與原核生物不同,真核生物的mRNA翻譯不直接與轉錄偶聯。在某些情況下甚至
可能發生 這樣的情況,即mRNA水平的降低卻伴隨著蛋白質水平的增加。
mRNA的翻譯
降解 同一細胞內的不同mRNA具有不同的壽命(穩定性)。在細菌細胞中,單個mRNA可以存活數秒至超過一小時,但
平均壽命 為1至3分鐘,因此,細菌mRNA的穩定性遠低於真核mRNA。
哺乳動物細胞 mRNA的壽命從幾分鐘到幾天不等。mRNA的穩定性越高,從該mRNA產生的蛋白質越多。 mRNA的
有限壽命 使細胞能夠快速改變
蛋白質合成 以回響其不斷變化的需求。有許多機制可導致mRNA的降解。
原核mRNA的降解
原核生物mRNA的降解是不同
核糖核酸酶 包括
核酸內切酶 ,3'
核酸外切酶 和5'核酸外切酶的共同作用的結果。在一些情況下,長度為數十至數百個核苷酸的小RNA分子(sRNA)可通過與
互補序列 鹼基配對 來促進RNase III對特定mRNA的降解。
真核mRNA的降解
真核細胞 的翻譯和mRNA衰變之間存在著平衡。正在被翻譯的mRNA被核糖體,
真核起始因子 eIF-4E和eIF-4G以及poly(A)
結合蛋白 結合,不能接觸
外泌體 複合物,mRNA得到保護。mRNA的poly(A)尾巴被
特異性 外切核酸酶 縮短,該核酸外切酶通過RNA上的
順式調節 序列和
反式作用RNA 結合蛋白的
組合定位 到特定mRNA。 Poly(A)尾巴被去除破壞了mRNA的環狀
循環結構 並降低了帽結合
複合體 的穩定性,導致mRNA會被外來體複合物或脫帽複合物降解。通過這種方式,可以快速降解翻譯不活躍的mRNA,而翻譯活躍的mRNA不受影響。
微小RNA
微小RNA(
miRNA )是小RNA,通常與後生生物mRNA中的序列部分互補。 miRNA與mRNA的結合可以抑制該mRNA的翻譯並加速poly(A)尾部去除,從而加速mRNA降解。
提取分離純化 真核細胞 的m
RNA 分子最顯著的結構特徵是具有5’端
帽子結構 (m7G)和3’端的Poly(A)尾巴。絕大多數
哺乳類 動物細胞 mRNA的3’端存在20-30個
腺苷酸 組成的Poly(A)尾,通常用Poly(A+)表示。這種結構為
真核 mRNA的提取,提供了極為方便的
選擇性標誌 ,寡聚(dT)纖維素或寡聚(U)瓊脂糖親合層析
分離純化 mRNA的理論基礎就在於此。mRNA的
分離方法 較多,其中以寡聚(dT)-纖維素柱層析法最為有效,已成為常規方法。此法利用mRNA 3’末端含有Poly(A+)的特點,在RNA流經寡聚(dT)纖維素柱時,在高鹽
緩衝液 的作用下,mRNA被特異地結合在柱上,當逐漸降低鹽的濃度時或在低
鹽溶液 和
蒸餾水 的情況下,mRNA被洗脫,經過兩次寡聚(dT)纖維柱後,即可得到較高純度的mRNA。寡聚(dT)纖維素柱純化mRNA。
檢測分析定量 對mRNA的檢測、分析及定量 方法
目標RNA的類型
同時定量的目標RNA的數量
用途
缺點
主要用於估測不同組織、細胞中目標mRNA的分子質量,可用於mRNA的粗略定量。
需要大量RNA;只可同時檢測一個或最多幾個mRNA;與PCR方法相比,靈敏度差、耗時。
通常為一個,但是如果使用混合探針,最多可同時檢測12種mRNA。
主要用於對不同類型細胞或組織中目標mRNA的檢測和定量。
需要特異性的反義雜交探針(通常帶放射性)。RNA酶保護法遠比Northern雜交靈敏,但靈敏度還是不如PCR法。
是檢測目標RNA的高靈敏度方法,即使目標RNA在細胞中拷貝數很低也可檢測。主要用於檢測不同細胞和組織中mRNA的相對豐度。
由於反轉錄PCR取決於反轉錄步驟和擴增步驟所使用的引物,經常可能出現假陽性結果;反轉錄步驟變化大;另外,產物量的測定方法有很多缺陷,如低解析度和低靈敏度。
通常為一個,但也可檢測多個目標RNA,參見Stanley和Szewczuk(2005)等的研究結果,他們在單個多重反應中同時分析過72個mRNA。
是檢測目標RNA的一種高靈敏及高精度的方法。即使目標RNA在細胞中拷貝數極少也適用。實時PCR比其他方法更靈敏、更快、更精確。最近10年內是檢測細胞中mRNA相對豐度的主要方法。不僅可用於mRNA的檢測,也可用於microRNA的檢測(參見Chen et al. 2005;Benes and Castoldi 2010)。
市場上銷售的幾種商業設備採用的檢測方法不同。另外,已出版了數百種描述實時定量PCR的方案。實時PCR的每個步驟都缺乏標準,導致可靠性和可重複性的比較即使可能,也很困難(Nolanet al. 2006;Derveaux etal. 2010)。對實時PCR提出了一些合理的建議和標準,規定了實時PCR結果發表所必需的最少信息量,也許會有助於解決目前的困境(Bustinet al. 2009;Bustin 2010)。
發展歷史 1961年,在加州理工學院的一個實驗室,科學家首次成功提取到mRNA。
1990年,威斯康星大學Wolff等才首次報導肌內注射mRNA到小鼠骨骼肌里,可以表達相應蛋白質並產生免疫反應。這揭示了mRNA技術用於疫苗研究的可能性。2年後,又有研究者將編碼激素的mRNA,直接注射至小鼠大腦中,發現有緩解尿崩症的作用。這說明mRNA具備成為治療性藥物的潛力。
2020年11月16日,Moderna公布了III期臨床數據,30000名接種者中,疫苗有效率94.5%,重症保護力100%。11 月 9 日,BioNTech的III 期臨床數據公布,mRNA 疫苗有效率超過 90%。12月,
美國食品和藥物管理局 (
FDA )授權一款運用mRNA(信使核糖核酸)技術研製的
新冠疫苗 的緊急使用許可。
2022年2月,
南非 一公司3日對當地媒體表示,該公司利用已公開的新冠疫苗核酸序列,開發出
非洲大陸 首款mRNA(信使核糖核酸)新冠疫苗,計畫2022年底前開展臨床試驗。
南非當地時間2022年2月4日,據南非主流媒體報導,南非生物技術公司阿菲利根(Afrigen)日前已成功研製生產出非洲大陸首個mRNA
新冠肺炎疫苗 ,該疫苗將於2022年11月正式投入臨床試驗。
2023年3月,據新華社,mRNA(信使核糖核酸)疫苗大多針對病毒而不是細菌。以色列特拉維夫大學發表聲明說,該校人員參與的研究團隊成功研發出一款針對鼠疫耶爾森菌的mRNA疫苗,該技術或將有助解決耐抗生素細菌的問題。聲明說,研究在動物模型中進行,所有接種這種mRNA疫苗的動物都完全實現了免受鼠疫耶爾森菌的侵害。這一新技術可快速開發出有效針對細菌的疫苗,以對抗由耐抗生素細菌引發的流行性疾病。相關論文已發表在美國《科學進展》雜誌上。
技術優勢 mRNA 疫苗技術路線相比更傳統疫苗具有三個重要的優勢:1)mRNA疫苗最為顯而易見的優勢就是快速。2)mRNA的第二個優勢是安全。3)mRNA疫苗的第三個優勢是高效。