專利背景
干擾素(IFN)是一類具有廣譜抗病毒活性的蛋白質,根據干擾素胺基酸結構、抗原性和細胞來源,可將其分為三類:α干擾素、β干擾素以及γ干擾素,其中α干擾素是套用較為廣泛的一類干擾素,臨床上主要用於治療B型肝炎、C型肝炎等病毒性疾病,也用作一些腫瘤化療藥物的聯合用藥。但是,重組蛋白藥物在生產或儲存時,其中的胺基酸易被修飾而產生各種變異體,這些變異體被稱作相關蛋白(Relatedproteins),具體的,這些相關蛋白的產生主要來自以下兩個方面:一是原核系統在表達異源蛋白質時,因其N末端胺基酸的不完全加工導致的產品N末端含有多種結構形式,如N末端甲硫胺醯化、乙醯化、甲醯化以及胺基酸殘基缺失等;二是干擾素本身化學降解會生成相關蛋白,如脫醯胺、氧化、水解等。相關蛋白的存在會帶來一些不良後果,尤其是結構上的變異可能會在患者體內產生免疫反應及副作用,進而影響重組蛋白藥物的臨床療效,因此,相關蛋白的分析及控制對於重組蛋白藥物的安全、有效使用來說尤為重要。
截至2014年11月,歐洲藥典是採用RP-HPLC法(即反相高效液相色譜法)分離檢測干擾素α2b中的大部分相關蛋白,而中國藥典還沒有採用上述方法檢測相關蛋白,同時,中國和歐洲藥典對干擾素α2b的N段序列的標準也有差異,具體如下表1所示:
項目 | 中國藥典2010 | 歐洲藥典8.0 |
|---|
電泳純度 | | |
|---|
SE-HPLC純度 | | |
|---|
RP-HPLC純度 | | |
|---|
比活性 | | |
|---|
等電點 | | |
|---|
N段序列 | | |
|---|
另外,在2014年度中國國家藥品評價性抽驗工作中,中國食品藥品檢定研究院李永紅等人在2014年期刊《藥物分析雜誌》的第34卷第7期第1204-1207頁發表了一篇名稱為“2種重組人干擾素α2b相關蛋白分析方法的套用比較”的文章,該文章對中國8家企業的24批重組人干擾素α2b進行了相關蛋白方面的研究,其中僅有兩家企業生產的重組人干擾素α2b中的相關蛋白符合歐洲藥典標準,另外有5家企業產品中的甲硫胺醯化相關蛋白(Met-IFN)含量在18%-38%之間,同時,該文章還表明歐洲藥典公開的上述方法無法檢測出Met-IFN。Met-IFN是由於蛋白質在原核系統翻譯時,起始密碼子AUG所翻譯的甲硫氨酸(Met)未被有效切除而形成的,它比干擾素α2b在N末端多了一個Met,因此可以通過N端測序來確認是否含有Met,而歐洲藥典關於干擾素α2b的N端測序檢測項中,其N末端是不允許有Met的存在,因此歐洲藥典實則是通過N端測序來確認是否含有Met-IFN,從而彌補RP-HPLC法無法檢測Met-IFN的缺陷。
上述技術表明,採用RP-HPLC法無法檢測分離重組人干擾素α2b中的Met-IFN,而中國的相關資料雖然可以通過一些分離純化方法得到高純度的重組人干擾素α2b,如名稱為“一種新的重組人干擾素α2b的分離純化方法”(專利號為CN1749274B)的中國專利公開了以下方案:包涵體復性後再依次經過疏水柱M1、CM、M2層析和S-100分子篩層析,即得純化產品;名稱為“一種重組人干擾素α2b(rhIFNα2b)原液的製備方法”(專利號為CN100355774C)的中國專利公開了以下步驟:包涵體復性後經DEAE、CM、SP層析,得純化產品;名稱為“一種干擾素的純化方法”(專利號為CN103014101A)的中國專利公開了以下步驟:包涵體復性後經陰離子柱、陽離子柱、反相填料柱層析,得純化產品,該純化產品的電泳純度可由90%提高到98%,SE-HPLC純度可由90%提高到98%,但是該方法也難以去除Met-IFN,同時其採用了有機溶劑洗脫,存在安全隱患,並易對蛋白質造成損傷,因此限制了干擾素的大規模生產及套用。上述現有技術多以電泳及SE-HPLC純度做為質控及評價指標,未見反相純度研究報告,也未指出得到的重組人干擾素α2b中是否含有Met-IFN,同時中國藥典也並未對Met-IFN提出檢測要求,鑒於重組人干擾素α2b與其相關蛋白的性質接近,如何通過純化方法去除相關蛋白一直是技術人員的研究難點。
發明內容
專利目的
《高純度重組人干擾素α2b的製備方法》的目的是提供一種高純度重組人干擾素α2b的製備方法。
技術方案
《高純度重組人干擾素α2b的製備方法》包括以下步驟:
a)將重組人干擾素α2b菌體裂解、復性,得復性產物;
b)將復性產物依次通過陽離子柱、疏水柱和陰離子柱層析純化,即得產品。
上述技術方案產生的有益效果在於:採用該發明公開的上述方法可以有效地除去重組人干擾素α2b中的包括Met-IFN在內的各種相關蛋白,從而有效提高產品的純度,其中步驟a可以通過現有的常規方法製得所需的復性產物。
具體的方案為:所述步驟b的陽離子柱層析方法為:採用緩衝液A預平衡陽離子交換介質後上樣,用緩衝液B進行第一次洗脫,待基線歸零後,用緩衝液C進行第二次洗脫,收集第二個蛋白洗脫峰的洗脫液;
所述的緩衝液A是磷酸氫二鈉-磷酸二氫鈉、檸檬酸-檸檬酸鈉、磷酸氫二鈉-檸檬酸、乙酸-乙酸鈉或Bis-Tris-鹽酸,緩衝液A的pH為3.6-6.0、濃度20-50摩爾/升;緩衝液B是加有50-100摩爾/升氯化鈉溶液的緩衝液A;緩衝液C是加有100-200摩爾/升氯化鈉溶液的緩衝液A;所述的陽離子交換介質為CM-SepharoseFF、SP-SepharoseFF、S-SepharoseFF或SP-SepharoseXL。所述的陽離子柱層析是採用等度洗脫模式收集得到大部分的重組人干擾素α2b,具體採用該步驟層析分離得到的重組人干擾素α2b含量高達50-60%。
進一步的,所述步驟b的疏水柱層析方法為:向陽離子柱層析收集的洗脫液中加入硫酸銨溶液至洗脫液中硫酸銨濃度為0.8-1.5M,採用緩衝液D預平衡疏水層析介質後上樣,用緩衝液E進行第一次洗脫,待基線歸零後,用緩衝液F進行第二次洗脫,收集第一個蛋白洗脫峰的洗脫液;
所述的緩衝液D是濃度為0.8-1.5摩爾的硫酸銨溶液,緩衝液E是濃度為0.4-0.7摩爾的硫酸銨溶液,緩衝液F是濃度為0.1-0.2摩爾的硫酸銨溶液;
所述的疏水層析交換介質為ButylSepharose4FF、OctylSepharose4FF或PhenylSepharose6FF,該發明通過上述的疏水柱層析分離可以有效地去除重組人干擾素α2b中的雜蛋白及相關蛋白。
另外,所述步驟b的陰離子層析方法為:將疏水柱層析收集的洗脫液稀釋5-10倍,採用緩衝液G預平衡陰離子交換介質後上樣,先用緩衝液H洗滌10-20個柱體積,然後再用緩衝液I洗脫,收集洗脫峰;
所述的緩衝液G磷酸氫二鈉-磷酸二氫鈉、硼酸-硼酸、Tris-鹽酸或甘氨酸-氫氧化鈉,緩衝液G的pH為7.4-9.0、濃度5-50摩爾/升;緩衝液H為磷酸氫二鈉-磷酸二氫鈉、Bis-Tris-鹽酸或乙酸-乙酸鈉,緩衝液H的pH為4.5-7.0、濃度10-50摩爾/升,且緩衝液H中含有0-50摩爾/升氯化鈉;緩衝液I為磷酸氫二鈉-磷酸二氫鈉、Bis-Tris-鹽酸或乙酸-乙酸鈉,緩衝液I的pH為4.5-7.0、濃度20-50摩爾/升,且緩衝液I中含有50-80摩爾/升氯化鈉;
所述的陰離子交換介質為Q-SepharoseFF、DEAE-SepharoseFF或Q-SepharoseXL,該發明通過上述的陰離子交換層析分離可以進一步的去除雜蛋白及相關蛋白,使製得的目標產物重組人干擾素α2b的純度得以顯著提高。
作為進一步的優選方案,所述步驟a的具體操作步驟如下:
1)按照1克:3毫升的質量體積比向重組人干擾素α2b菌體中加入6摩爾鹽酸胍,在3-5℃條件下攪拌裂解4h,得裂解液;
2)將裂解液裝入透析袋中,依次透析pH7.4的PBS兩次、pH3.0的20摩爾/升醋酸兩次以使裂解液復性;
3)將復性的裂解液離心,取上清液過濾,得到的濾液即為復性產物。
改善效果
《高純度重組人干擾素α2b的製備方法》是將裂解的菌體即包涵體直接裝入透析袋中透析復性,這樣可以有效避免包涵體洗滌的繁瑣步驟和目標產物的損失,提高製備效率,同時,該發明採用陽離子柱、疏水柱和陰離子柱的組合依次層析的方式極為有效的捕獲重組人干擾素α2b,以及去除其中的雜蛋白和相關蛋白,經檢測,採用該發明公開的製備方法得到的重組人干擾素α2b的RP-HPLC檢測純度大於95%,有效地去除了各種相關蛋白;同時N端測序結果證實其不含Met-IFN,如此可以有效避免在患者體內產生免疫反應及副作用,進而保證重組人干擾素α2b的臨床療效和使用安全。
《高純度重組人干擾素α2b的製備方法》所提供的純化工藝採用離子交換、疏水層析兩種基礎層析模式,能極為有效去除干擾素相關蛋白,所獲產品反相HPLC純度大於95%。
附圖說明
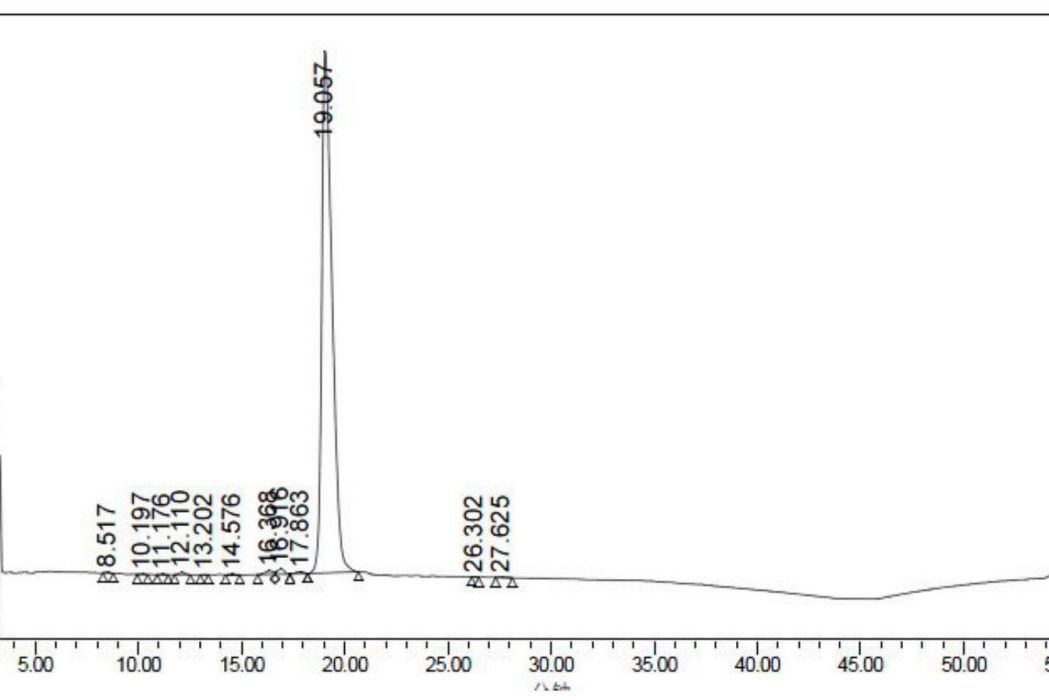
圖1是重組人干擾素α2b的RP-HPLC法純度檢測圖譜;
圖2是重組人干擾素α2b的電泳圖譜;
圖3(a)、(b)、(c)是重組人干擾素α2b的N末端測序圖譜;
圖4是重組人干擾素α2b的SE-HPLC圖譜。
技術領域
《高純度重組人干擾素α2b的製備方法》涉及醫藥技術領域,具體涉及一種高純度重組人干擾素α2b的製備方法。
權利要求
1.《高純度重組人干擾素α2b的製備方法》包括以下步驟:a)將重組人干擾素α2b菌體裂解、復性,得復性產物;b)將復性產物依次通過陽離子柱、疏水柱和陰離子柱層析純化,即得產品;所述的陽離子柱層析方法為:採用緩衝液A預平衡陽離子交換介質後上樣,用緩衝液B進行第一次洗脫,待基線歸零後,用緩衝液C進行第二次洗脫,收集第二個蛋白洗脫峰的洗脫液;
所述的疏水柱層析方法為:向陽離子柱層析收集的洗脫液中加入硫酸銨溶液至洗脫液中硫酸銨濃度為0.8-1.5摩爾,採用緩衝液D預平衡疏水層析介質後上樣,用緩衝液E進行第一次洗脫,待基線歸零後,用緩衝液F進行第二次洗脫,收集第一個蛋白洗脫峰的洗脫液;
所述的陰離子柱層析方法為:將疏水柱層析收集的洗脫液稀釋5-10,採用緩衝液G預平衡陰離子交換介質後上樣,先用緩衝液H洗滌10-20個柱體積,然後再用緩衝液I洗脫,收集第一個洗脫峰;
所述的緩衝液G為磷酸氫二鈉-
磷酸二氫鈉、
硼酸-硼酸鈉、Tris-鹽酸或甘氨酸-氫氧化鈉,緩衝液G的pH為7.4-9.0、濃度5-50摩爾/升;緩衝液H為磷酸氫二鈉-磷酸二氫鈉、Bis-Tris-鹽酸或乙酸-乙酸鈉,緩衝液H的pH為4.5-7.0、濃度10-50摩爾/升,且緩衝液H中含有0-20摩爾/升氯化鈉;緩衝液I為磷酸氫二鈉-
磷酸二氫鈉、Bis-Tris-鹽酸或乙酸-乙酸鈉,緩衝液I的pH為4.5-7.0、濃度20-50摩爾/升,且緩衝液I中含有50-80摩爾/升氯化鈉;
所述的陰離子交換介質為Q-SepharoseFF、DEAE-SepharoseFF或Q-SepharoseXL。
2.根據權利要求1所述的高純度重組人干擾素α2b的製備方法,其特徵在於:所述的緩衝液A是磷酸氫二鈉-磷酸二氫鈉、檸檬酸-檸檬酸鈉、磷酸氫二鈉-檸檬酸、乙酸-乙酸鈉或Bis-Tris-鹽酸,緩衝液A的pH為3.6-6.0、濃度20-50摩爾/升;緩衝液B是加有50-100摩爾/升氯化鈉溶液的緩衝液A;緩衝液C是加有100-200摩爾/升氯化鈉溶液的緩衝液A;所述的陽離子交換介質為CM-SepharoseFF、SP-SepharoseFF、S-SepharoseFF或SP-SepharoseXL。
3.根據權利要求1或2所述的高純度重組人干擾素α2b的製備方法,其特徵在於:所述的緩衝液D是濃度為0.8-1.5摩爾的硫酸銨溶液,緩衝液E是濃度為0.4-0.7摩爾的硫酸銨溶液,緩衝液F是濃度為0.1-0.2摩爾的硫酸銨溶液;所述的疏水層析交換介質為ButylSepharose4FF、OctylSepharose4FF或PhenylSepharose6FF。
4.根據權利要求1所述的高純度重組人干擾素α2b的製備方法,其特徵在於:所述步驟a的具體操作步驟如下:
1)按照1克:3毫升的質量體積比向重組人干擾素α2b菌體中加入6摩爾鹽酸胍,在3-5℃條件下攪拌裂解4h,得裂解液;
2)將裂解液裝入透析袋中,依次透析pH7.4的PBS兩次、pH3.0的20摩爾/升醋酸兩次以使裂解液復性;
3)將復性的裂解液離心,取上清液過濾,得到的濾液即為復性產物。
實施方式
1)收集大腸桿菌表達的重組人干擾素α2b發酵後所獲的菌體,該菌體通過常規技術即可獲取,然後按1克:3毫升的比例向該菌體中加入6摩爾鹽酸胍溶解,在4℃攪拌裂解4小時,得到裂解液;
2)將裂解液倒入透析袋,按1:10的體積比對pH7.4的PBS進行透析,每4小時換透析液一次,共2次,然後再按1:10的體積比對pH3.0的20摩爾/升醋酸進行透析,每4小時換透析液一次,共2次,得到復性的裂解液;
3)將復性的裂解液在8000克、15分鐘條件下離心,取上清液並過濾,得到的濾液即為復性產物。
1)陽離子柱層析純化:陽離子柱交換介質CM-SepharoseFF經pH3.6的50摩爾/升乙酸-乙酸鈉平衡後,以實施例1的復性產物作為上樣液上樣,然後先用含100摩爾/升氯化鈉、50摩爾/升乙酸-乙酸鈉的pH為3.6的緩衝液洗滌5-10個柱體積,再用含200摩爾/升氯化鈉、50摩爾/升乙酸-乙酸鈉的pH為3.6的緩衝液洗脫,收集目標峰的洗脫液;
2)疏水柱層析純化:向陽離子柱層析收集的洗脫液中加入硫酸銨至其中的硫酸銨濃度為1.5摩爾,疏水柱層析交換介質Butyl-Sepharose4FF經1.5摩爾硫酸銨預平衡後上樣,然後先用0.7摩爾硫酸銨洗滌5-10個柱體積,再用0.2摩爾硫酸銨洗脫,收集目標峰的洗脫液。
3)陰離子柱層析純化:將疏水柱層析收集的洗脫液用水稀釋10倍,陰離子柱交換介質DEAESepharoseFF經pH為9.0的20摩爾/升Tris-鹽酸預平衡後上樣,然後先用含20摩爾/升氯化鈉、50摩爾/升Bis-Tris-鹽酸的pH為7.0的緩衝液洗滌10-20個柱體積,再用含80摩爾/升氯化鈉、pH為7.0的50摩爾/升Bis-Tris-鹽酸的緩衝液洗脫,收集目標峰的洗脫液,即為高純度重組人干擾素α2b。
1)陽離子柱層析純化:陽離子柱交換介質SP-Sepharose經pH為6.0的30摩爾/升磷酸氫二鈉-磷酸二氫鈉平衡後,以實施例1的復性產物作為上樣液上樣,然後先用含50摩爾/升氯化鈉、30摩爾/升磷酸氫二鈉-磷酸二氫鈉pH為6.0的緩衝液洗滌5-10個柱體積,再用含100摩爾/升氯化鈉、20摩爾/升磷酸氫二鈉-磷酸二氫鈉pH為6.0的緩衝液洗脫,收集目標峰的洗脫液;
2)疏水柱層析純化:向陽離子柱層析收集的洗脫液中加入硫酸銨至其中的硫酸銨濃度為1.0摩爾,疏水柱層析交換介質Octyl-Sepharose4FF經1.0摩爾硫酸銨預平衡後上樣,然後先用0.5摩爾硫酸銨洗滌5-10個柱體積,再用0.15摩爾硫酸銨洗脫,收集目標峰的洗脫液。
3)陰離子柱層析純化:將疏水柱層析收集的洗脫液用水稀釋7倍,陰離子柱交換介質Q-SepharoseFF經pH為7.4的50摩爾/升磷酸氫二鈉-磷酸二氫鈉預平衡後上樣,然後先用含10摩爾/升氯化鈉、10摩爾/升乙酸-乙酸鈉的pH為4.5的緩衝液洗滌10-20個柱體積,再用含50摩爾/升氯化鈉、20摩爾/升乙酸-乙酸鈉pH為4.5的緩衝液洗脫,收集目標峰的洗脫液,即為高純度重組人干擾素α2b。
1)陽離子柱層析純化:陽離子柱交換介質S-SepharoseFF經pH5.0的20摩爾/升檸檬酸-檸檬酸鈉平衡後,以實施例1的復性產物作為上樣液上樣,然後先用含60摩爾/升氯化鈉、20摩爾/升檸檬酸-檸檬酸鈉pH為5.0的緩衝液洗滌5-10個柱體積,再用含120摩爾/升氯化鈉、20摩爾/升檸檬酸-檸檬酸鈉pH為5.0的的緩衝液洗脫,收集目標峰的洗脫液;
2)疏水柱層析純化:向陽離子柱層析收集的洗脫液中加入硫酸銨至其中的硫酸銨濃度為0.8摩爾,疏水柱層析交換介質Phenyl-Sepharose6FF經0.8摩爾硫酸銨預平衡後上樣,然後先用0.4摩爾硫酸銨洗滌5-10個柱體積,再用0.1摩爾硫酸銨洗脫,收集目標峰的洗脫液。 3)陰離子柱層析純化:將疏水柱層析收集的洗脫液用水稀釋5倍,陰離子柱交換介質QSepharoseXL經pH8.0的5摩爾/升甘氨酸-氫氧化鈉預平衡後上樣,然後先用pH為6.0的40摩爾/升磷酸氫二鈉-磷酸二氫鈉洗滌10-20個柱體積,再用含60摩爾/升氯化鈉、pH為6.0的40摩爾/升磷酸氫二鈉-磷酸二氫鈉的緩衝液洗脫,收集目標峰的洗脫液,即為高純度重組人干擾素α2b。 所述的實施例2-4採用陽離子柱、疏水柱和陰離子柱的組合依次層析的方式能夠有效的捕獲重組人干擾素α2b,以及去除其中的雜蛋白和相關蛋白,經檢測,上述實施例得到的重組人干擾素α2b的RP-HPLC檢測純度大於95%,比活大於4×108IU/毫克,電泳及SE-HPLC純度均大於99%。
實施例5:重組人干擾素α2b的純度檢測
1、RP-HPLC法純度檢測:
採用十八烷基矽烷鍵合矽膠色譜柱,規格為:柱4.6毫米×250毫米,孔徑30納米,粒徑5微米;流動相A為700毫升純水+2毫升三氟乙酸+300毫升色譜純乙腈;流動相B為200毫升純水+2毫升三氟乙酸+800毫升色譜純乙腈;流速1.0毫升/分鐘;在室溫下進行梯度洗脫,具體的梯度參數見表2,實施例3製得的重組人干擾素α2b的進樣量不低於50μ克,檢測結果如附圖1所示,按面積歸一法計算重組人干擾素α2b的純度,結果如下表3,從中可以看出,重組人干擾素α2b的RP-HPLC法檢測純度高達97.82%。
表3RP-HPLC法純度檢測計算結果
2、電泳純度檢測:
1)樣品處理:
測試溶液a:實施例3製得的重組人干擾素α2b用電泳的上樣緩衝液(以下簡稱buffer)稀釋至濃度為0.5毫克/毫升;
測試溶液b:測試溶液a用buffer稀釋5倍,濃度為0.1毫克/毫升;
參照溶液c:取重組人干擾素α2b標準品用buffer溶解,濃度為0.625毫克/毫升;
參照溶液d:參照溶液c用buffer稀釋5倍,濃度為0.125毫克/毫升;
參照溶液e:參照溶液d用buffer稀釋5倍,濃度為0.025毫克/毫升;
參照溶液f:參照溶液e用buffer稀釋5倍,濃度為0.005毫克/毫升;
參照溶液克:參照溶液f用buffer稀釋5倍,濃度為0.001毫克/毫升;
將上述的測試溶液與參照溶液置於含蓋的測試管,沸水水浴2分鐘。
2)電泳
根據電泳儀器使用手冊開始電泳,所述的各溶液a-克的上樣體積均為50微升,分離膠為14%聚丙烯醯胺,採用銀染法染色。
3)判定條件
採用參比法,電泳結果在滿足以下條件時即可對測試樣品進行評價:①參照溶液克條帶可見;②測試溶液a與測試溶液b的條帶有色差梯度;③參照溶液c-克的條帶均有色差梯度。
4)合格判定標準
測試溶液a中沒有超過一條雜帶比參照溶液f主條帶顏色更深的條帶;沒有超過三條雜帶比參照溶液克主條帶顏色深的條帶。此時,可以判定樣品電泳純度大於99%。
5)結果
如圖2所示,樣品和標準品自左向右分別為測試溶液a、b以及參照溶液c-克,從圖中可以看出:該電泳符合上述判定條件;且測試溶液a沒有雜帶比參照溶液f主條帶顏色更深,沒有超過三條雜帶比參照溶液克主條帶顏色深的條帶,符合上述合格判定標準。因此可判定該檢測樣品的電泳純度大於99%。
3、N末端測序:
採用PPSQ-33A全自動蛋白質多肽測序儀(由中國科學院上海生命科學研究院檢測)檢測實施例3製得的重組人干擾素α2b的N末端序列,測序圖譜如圖3(a)、(b)、(c)所示,分析結果表明,重組人干擾素α2b的N末端15個胺基酸序列為:
NH2-Cys-Asp-Leu-Pro-Gln-Thr-His-Ser-Leu-Gly-Ser-Ar克-Ar克-Thr-Leu,從中可以看出第一個循環未見Met,由此可以判定採用該發明製備得到的重組人干擾素α2b中不含甲硫胺醯化相關蛋白Met-IFN。
4、SE-HPLC法純度檢測:
採用現有技術常規的SE-HPLC法檢測實施例3製得的重組人干擾素α2b的純度,檢測圖譜如圖4所示,按面積歸一法計算重組人干擾素α2b的純度,結果下表4,從中可以明顯看出,重組人干擾素α2b的SE-HPLC法檢測純度高達99.70%。
峰號 | 保留時間/分鐘 | 峰面積/(μV·S) | 面積/% |
|---|
1 | | | |
|---|
2 | | | |
|---|
3 | | | |
|---|
總計 | | | |
|---|
榮譽表彰
2019年5月16日,《高純度重組人干擾素α2b的製備方法》獲得安徽省第六屆專利獎金獎。