專利背景
干擾素屬蛋白質類物質,可廣泛套用於治療各種疾病。但是蛋白質類物質在水性溶液中容易變性或者喪失其生物活性,因此通常將其製成凍乾製劑或通過添加穩定劑將其製成液體製劑。由於凍乾製劑的凍乾工藝複雜且操作費用高,病人使用之前還需要復溶,因此從經濟和使用便捷性方面考慮,更趨向於研製可長期穩定保存干擾素液體製劑。
重組人干擾素α2b屬於干擾素的一種,被廣泛的套用於急慢性病毒性肝炎(乙型、丙型)、尖銳濕疣、毛細胞性白血病、慢性粒細胞白血病等的治療。2013年3月前將其製成液體製劑的研究主要有以下報導:
名稱為“穩定的α干擾素水溶液製劑”(CN1160355A)的中國專利文獻公開了以下方案:採用穩定劑(多乙氧基醚80)、螯合劑(乙二胺四乙酸鹽)、張力劑(氯化鈉)、抗菌防腐劑(間-甲酚)、緩衝劑和干擾素α-2b製成pH範圍在4.5~7.1的重組人干擾素液體製劑。
名稱為“一種穩定的重組人干擾素製劑”(CN1255377A)的中國專利文獻公開了以下方案:採用pH5.0~7.5的檸檬酸鹽緩衝液,氯化鈉濃度為0.4-1.0%,然後加入助劑物質,即濃度為0.1-1‰的EDTA、製劑中含濃度為1-20微升/100毫升的Tween80、製劑中含保護劑濃度為0.5-1.8‰的對羥基苯甲酸甲酯和濃度為0.05-0.18‰的對羥基苯甲酸丙酯,同時通以無菌過濾的
氮氣,使溶液中氧氣含量低於0.25ppm,最後加入重組人α-干擾素蛋白100-600萬單位/毫升,配置成水針製劑。
以及,名稱為“一種穩定的干擾素水溶液”(CN1256148A)的中國專利文獻公開的方案:該干擾素由α干擾素、穩定劑、等滲劑、pH4.5-9.0範圍的緩衝體系、非離子表面活性劑(聚氧乙烯失水山梨醇單油酸酯)、製劑用水配置而成,不含防腐劑。
上述三種方案中,雖然都能夠製取得到穩定的干擾素液體製劑,但其所採用的方案中均不同程度的需要添加表面活性劑和/或防腐劑。而表面活性劑和防腐劑的添加會帶來安全風險,如表面活性劑:聚山梨酯80,會發引發過敏反應,產生皮疹、
蕁麻疹、呼吸抑制、心跳過速、溶血等不良反應,發生率約為5%~40%;
丙二醇、
聚乙二醇和
苯甲醇也都均可引起溶血現象。另外,防腐劑雖然能抑菌生長,但其帶來的安全風險非常大,兒童用藥和靜脈注射中都已明確規定禁用防腐劑。
發明內容
專利目的
《一種重組人干擾素α2b製劑》的首要目的是提供一種可直接注射用的重組人干擾素α2b製劑,不含有表面活性劑和防腐劑,且穩定性好、存儲時間長,使用風險低。該發明的另一目的是提供該重組人干擾素α2b製劑的製備方法。
技術方案
《一種重組人干擾素α2b製劑》首要目的採取的方案為:該發明的製劑是由以下組分和製劑用水構成:
該製劑的pH值為6.0-7.5。
《一種重組人干擾素α2b製劑》中通過長期對重組人干擾素α2b穩定性、活性實驗研究發現,按上述方案配製的重組人干擾素α2b製劑,可在不加入表面活性劑和防腐劑的同時,能夠在2~8℃條件下能穩定重組人干擾素α2b有效期2年以上,在25℃條件下能保持有效期6個月以上,在振搖和反覆凍融等破壞性試驗中也能很好的保持重組人干擾素α2b活性和穩定性;提高重組人干擾素α2b製劑使用的安全性。另外該發明中也不需要採用人血清白蛋白作為穩定劑,防止血液製品帶來的污染風險,降低醫藥的生產成本。
《一種重組人干擾素α2b製劑》的另一目的方法包括以下步驟:
S1:按製劑的原料比稱取各原料藥品待用;
S2:將稱取好的氯化鈉配置成氯化鈉水溶液,然後將稱取好的磷酸鹽緩衝液、乙二胺四乙酸二鈉鹽、組氨酸按順序依次加入氯化鈉水溶液中溶解混勻配製成穩定劑母液,磷酸鹽緩衝液、乙二胺四乙酸二鈉鹽和組氨酸各原料的加入是分別在前一原料完全溶解混勻後再加入後一原料進行溶解混勻;
S3:將稱取好的重組人干擾素α2b加入S2中得到的穩定劑母液中,混勻後再加製劑用水進行定容,使得混合溶液中各原料組分的濃度與製劑的要求相一致,再將定容後的溶液經濾膜過濾除菌後即可製得該製劑。
改善效果
通過上述操作方法依次溶解各原料和經濾膜過濾除菌後即可製得該能夠穩定儲存且保持重組人干擾素α2b活性的製劑。具體實施時,優選採用磷酸二氫鈉和磷酸氫二鈉配製磷酸鹽緩衝液,以取得最佳效果。可根據製劑的PH值來選取磷酸二氫鈉和磷酸氫二鈉的比例進行配置。
為了獲取更好的儲存穩定性和臨床治療效果,該申請優選採用以下方案生產該重組人干擾素α2b製劑,亦即:該製劑是由以下組分和製劑用水構成,該實施方案相對於實現《一種重組人干擾素α2b製劑》目的的其它技術參數方案在製劑的穩定性、重組人干擾素α2b活性以及臨床治療效果上都有顯著的提升。
附圖說明
圖1是《一種重組人干擾素α2b製劑》製得的重組人干擾素α2b的蛋白純度檢測結果。
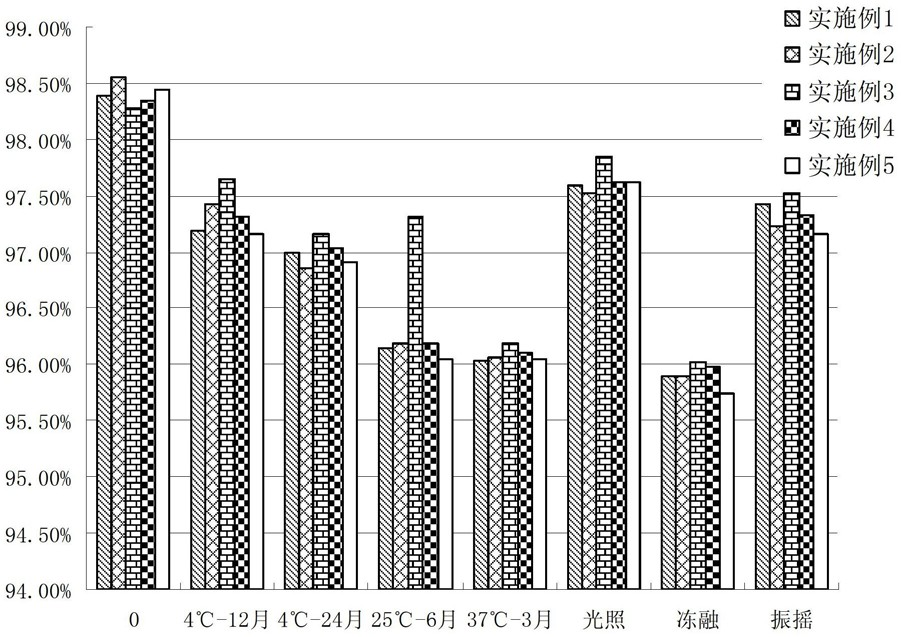
圖1
技術領域
《一種重組人干擾素α2b製劑》涉及醫藥領域,具體涉及一種可直接注射用的重組人干擾素α2b製劑及其製備方法。
權利要求
1.《一種重組人干擾素α2b製劑》是由以下組分和製劑用水構成:
該製劑的pH值為6.0-7.5。
2.如權利要求1所述的注射用重組人干擾素α2b製劑,其特徵在於:磷酸鹽緩衝液由磷酸二氫鈉和磷酸氫二鈉配製而成。
3.如權利要求2所述的重組人干擾素α2b製劑,其特徵在於:該製劑是由以下組分和製劑用水構成,
該製劑的pH值為7.0。
4.一種如權利要求1所述的重組人干擾素α2b製劑的製備方法,包括以下操作步驟:
S1:按製劑的原料比稱取各原料藥品待用;
S2:將稱取好的氯化鈉配置成氯化鈉水溶液,然後將稱取好的磷酸鹽緩衝液、乙二胺四乙酸二鈉鹽、組氨酸按順序依次加入氯化鈉水溶液中溶解混勻配製成穩定劑母液,磷酸鹽緩衝液、乙二胺四乙酸二鈉鹽和組氨酸各原料的加入是分別在前一原料完全溶解混勻後再加入後一原料進行溶解混勻;
S3:將稱取好的重組人干擾素α2b加入S2中得到的穩定劑母液中,混勻後再加製劑用水進行定容,使得混合溶液中各原料組分的濃度與製劑的要求相一致,再將定容後的溶液經濾膜過濾除菌後即可製得該製劑。
實施方式
以下通過具體實施例來對該申請作進一步的詳細說明,但以下實施例不應構成限制《一種重組人干擾素α2b製劑》保護範圍的理由。其中實施例1~4為該申請的具體實施方案,實施例5為利用該發明公開的製備方法製取與2013年3月前技術中重組人干擾素α2b製劑組分相一致的重組人干擾素α2b製劑的實施方案,實施例6是對實施例1~5中製取得到的重組人干擾素α2b製劑在不同條件下的穩定性進行測試的實驗,實施例7為實施例4中製取得到的重組人干擾素α2b製劑在不同條件性的蛋白純度進行檢測的實驗。
實施例1
取氯化鈉9克,加入製劑用水500毫升溶解混勻,按順序依次加入5毫摩爾pH6.0磷酸二氫鈉-磷酸氫二鈉,100毫克乙二胺四乙酸二鈉鹽,1克組氨酸分別進行溶解混勻得到穩定劑母液;然後再量取重組人干擾素α2b1.0×10IU,緩慢加入穩定劑母液中,混勻,加製劑用水定容至1000毫升,混勻;最後將配製好的含有重組人干擾素α2b的溶液用濾膜過濾除菌後,即可得到重組人干擾素α2b製劑。
實施例2
取氯化鈉9克,加入製劑用水500毫升溶解混勻,按順序依次加入10毫摩爾pH6.5磷酸二氫鈉-磷酸氫二鈉,300毫克乙二胺四乙酸二鈉鹽,2克組氨酸分別進行溶解混勻得到穩定劑母液;然後再量取重組人干擾素α2b3.0×10IU,緩慢加入穩定劑母液中,混勻,加製劑用水定容至1000毫升,混勻;最後將配製好的含有重組人干擾素α2b的溶液用濾膜過濾除菌後,即可得到重組人干擾素α2b製劑。
實施例3
取氯化鈉9克,加入製劑用水500毫升溶解混勻,按順序依次加入15毫摩爾pH7.0磷酸二氫鈉-磷酸氫二鈉,500毫克乙二胺四乙酸二鈉鹽,2克組氨酸分別進行溶解混勻得到穩定劑母液;然後再量取重組人干擾素α2b3.0×10IU,緩慢加入穩定劑母液中,混勻,加製劑用水定容至1000毫升,混勻;最後將配製好的含有重組人干擾素α2b的溶液用濾膜過濾除菌後,即可得到重組人干擾素α2b製劑。
實施例4
取氯化鈉9克,加入製劑用水500毫升溶解混勻,按順序依次加入20毫摩爾pH7.5磷酸二氫鈉-磷酸氫二鈉,1克乙二胺四乙酸二鈉鹽,5克組氨酸分別進行溶解混勻得到穩定劑母液;然後再量取重組人干擾素α2b6.0×10IU,緩慢加入穩定劑母液中,混勻,加製劑用水定容至1000毫升,混勻;最後將配製好的含有重組人干擾素α2b的溶液用濾膜過濾除菌後,即可得到重組人干擾素α2b製劑。
實施例5
取氯化鈉9克,加入製劑用水500毫升溶解混勻,按順序依次加入10毫摩爾pH7.0磷酸二氫鈉-磷酸氫二鈉,100微升吐溫80,20克人血白蛋白分別進行溶解混勻得到穩定劑母液,然後再量取重組人干擾素α2b6.0×10IU,緩慢加入穩定劑母液中,混勻,加製劑用水定容至1000毫升,混勻;最後將配製好的含有重組人干擾素α2b的溶液用濾膜過濾除菌後,即可得到重組人干擾素α2b製劑。
實施例6
為了確定《一種重組人干擾素α2b製劑》公開的重組人干擾素α2b製劑的穩定性,分別將實施例樣品置於2~8℃、25℃、37℃條件下保存,在規定時間點取樣,對實施例1~5中製取得到的重組人干擾素α2b製劑進行穩定性考察。分別將實施例樣品置於裝有日光燈的冰櫃里,照度條件為4500±5001x,溫度6±2℃,第10天取樣,按考察項目檢測。分別將實施例樣品在避光,室溫下,置於搖床(250轉/分鐘)中振搖8d,按考察項目檢測。分別將供試品置於-20℃冰櫃中12小時使供試品溶液完全凍結,然後取出置於2~8℃冰櫃中8小時使供試品溶液完全融化成液體狀態,如此反覆6次,分別取樣檢測。結果:該發明製取的可直接注射使用的製劑在2~8℃條件下能穩定重組人干擾素α2b有效期至2年以上,在25℃條件下能穩定儲存6個月以上,在光照、振搖和反覆凍融等破壞性試驗中也能很好的保持重組人干擾素α2b的活性和穩定,具體結果詳見表1~6。
表1:實施例1~5製取的製劑在2~8℃貯存12個月的穩定性結果
表2:實施例1~5製取的製劑在2~8℃貯存24個月的穩定性結果
實施例7
《一種重組人干擾素α2b製劑》製取的製劑可以通過採用高效液相色譜法檢測其蛋白純度,高效液相色譜檢測所採取色譜條件為:色譜柱TSKG2000SWXL;流動相為0.1摩爾/升-磷酸鹽0.1摩爾/升氯化鈉緩衝液,pH7.0;上樣量200微升;在波長214納米處檢測,以重組人干擾素α2b色譜峰計算的理論塔板數應不低於1000。按面積歸一化法計算,重組人干擾素α2b主峰面積應不低於總面積的95%。其中附圖1為實施例1~實施例5製取得到的製劑分別在4℃、25℃、37℃條件下和光照、振搖及反覆凍融試驗中的蛋白純度的檢測結果。
榮譽表彰
2016年12月7日,《一種重組人干擾素α2b製劑》獲得第十八屆中國專利優秀獎。