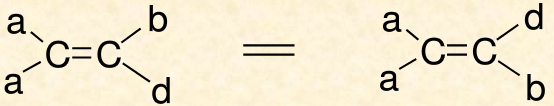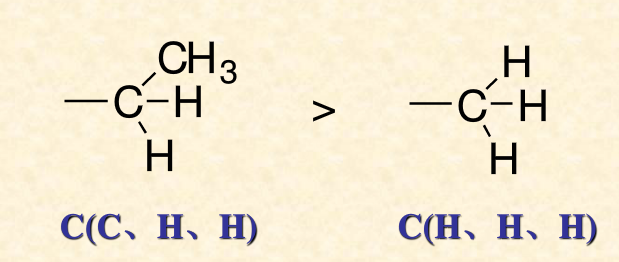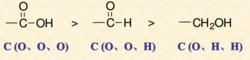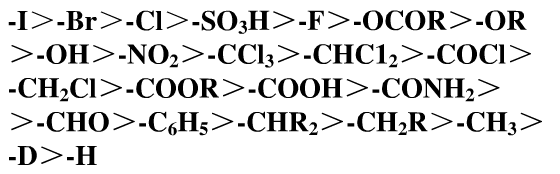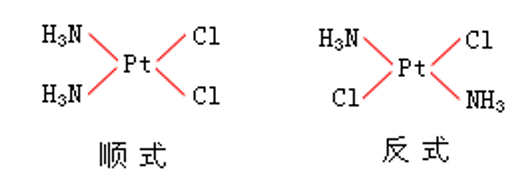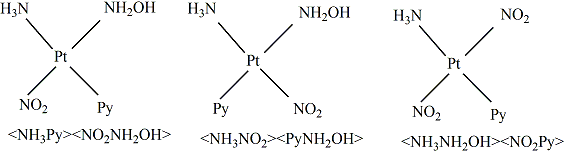發現歷史,定義內容,概念辨析,產生條件,命名法,順反異構命名法,Z-E命名法,次序規則,配合物的異構,平面正方形配合物,正八面體配合物,性質差異,物理性質,化學性質,紫外光譜,紅外光譜,互相轉換,分析測定方法,高效液相色譜法,毛細管電泳法,氣相色譜法,活性套用,活性不同,藥效不同,
發現歷史 貝采里烏斯建議把相同組成而不同性質的物質稱為“同分異構(isomerism)‘’的物質。同分異構現象的發現以及從理論上的闡明,是在物質組成和緒構理論發展中邁出的重要一步,它開始了分子結構問題的研究,促進了有機化學的發展。
在發現了酒石酸的旋光異構之後,1874年9月荷蘭物理化學家
范特霍夫 (
Jacobus Hendricus Van't Hoff .1852-1911)論帕斯特成果的小冊子《化學的結構式......空間分布論》(Voorstel tot Uibreiding der...Structuur Formules in de Ruimte)在
烏特勒支 出版;1874年11月法國化學家勒·貝爾(
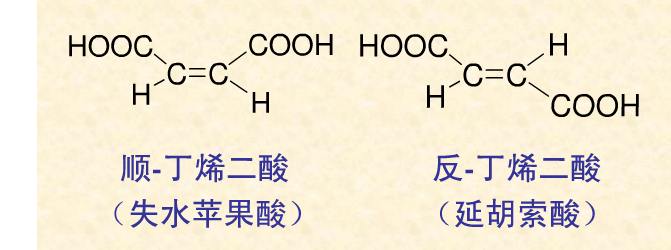
Joseph Achille Lebel .1847-1930)的論文發表在巴黎的《化學會會刊》(Bulletin de La Societe Chimique)上,兩人分別獨立能用幾何異構來解釋延胡索酸Fumaric acid(反-丁烯二酸)和
馬來酸 Maleic acid(順-丁烯二酸)的異構現象。假定,圍繞分子中兩個碳原子的兩個四面體,沿著四面體的一邊聯合在一起,表示不能轉動的雙鍵,然後,把氫基和羧基安置到兩個模型中區,使他們不能重合。它們並不是旋光異構體,它們的物理性質有所差別,由此發現了順反異構。
1964年,德國化學家肖萊馬通過對脂肪烴的研究,認真考察了有機結構與性質的關係,證實了碳原子4個化學價的統一性,對同分異構現象作出合理的解釋,使有機結構理論定型化。
定義內容 概念辨析 同分異構 是指分子式相同但
結構式 不同的異構現象,它包括
構造異構 和立體異構。立體異構指的是原子或
原子團 互相連線的次序相同,但在空間的排列方式不同的異構現象。而順反異構是指空間構象不同,順反異構屬於立體異構,故也屬於同分異構。
產生條件 1.分子中至少有一個鍵不能自由旋轉(否則將變成另外一種分子);
2.每個不能自由旋轉的同一碳原子上不能有相同的基團,必須連有兩個不同原子或原子團。
而下圖,這兩個模型都是不存在順反異構現象的一般構型,這是因為左側存在相同的原子或原子團,旋轉之後還是同一個構型:
示例: 下圖中,除中間的雙鍵存在順反異構外,其餘兩側的碳原子沒有順反異構,這是因為旁邊連線有兩個相同的氫原子基團。
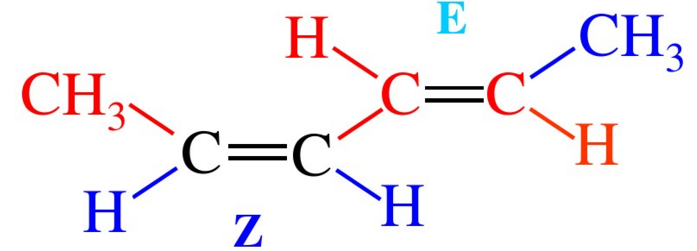
命名法 順反異構命名法 兩個相同原子或
基團 在
雙鍵 或脂環的同側的為順式
異構體 ,也用
cis- 來表示。
兩個相同原子或
基團 在
雙鍵 或脂環的異側的為反式
異構體 ,也用
trans- 來表示。
用順反異構命名法命名的有機化合物例舉
順反命名法命名存在一個缺陷:若雙鍵上兩個
碳原子 上連有四個完全不同的原子或基團,就無法命名,因此國際規定了標準的Z-E命名法。但Z-E異構命名法不適用於因脂環引起的順反異構的命名,這是因為脂環中的任一個碳原子已經連有兩個相同的原子(碳原子),不存在連線四個完全不同
基團 的可能性。
兩個碳原子上沒有全連有四個相同的原子或基團的順反異構體,既可以用Z-E命名法,也可以用順反異構命名法。但需要注意的是,順反異構體的命名與Z-E構型的命名不是完全相同的。這是兩種不同的命名法,故順式不一定就是Z型,反式不一定就是E型。
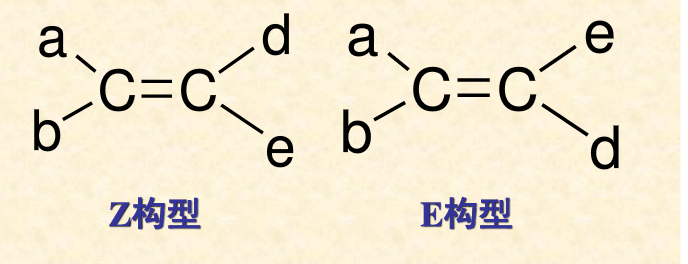
Z-E命名法 國際統一規定:按“
順序規則 ”分別比較每個碳原子上連線的兩個原子或基團,若兩個
較優基團 在
π鍵 平面同側者為Z型異構體,在異側者為E型異構體。Z和E分別取自德語單詞“Zusammen”和“Entgegen”的首位字母,前者意思是“在一起”,後者的意思是“相反,相對”。
現假設下圖構型式中的基團的次序是
,則它們的構型取決於a和d是在同側還是異側:
對於多烯烴的ZE異構,每個雙鍵的構型均須要標出。對雙鍵的第一個原子進行標號,並寫在構型符號前面。雙鍵若從兩邊編號構型相同且編號加總數不變時,Z型先標出。如下圖所示,此化合物命名為(2Z,4E)-2-4-己二烯,而命名為(2E,4Z)-2-4-己二烯則是錯誤的。
用Z-E命名法命名的有機化合物舉例
次序規則 1.由碳上直接相連的兩個原子的
原子序數 的大小來決定,原子序數大者為優。如I>Br>Cl>O>C>H。
若兩個原子為同位素時,則比較
相對原子質量 數大小,質量高的為較優基團。如T>D>H。
2.若與碳原子直接相連的第一個原子相同,要依次比較第二個甚至第三個原子,依此類推,直到比較出優先順序為止。
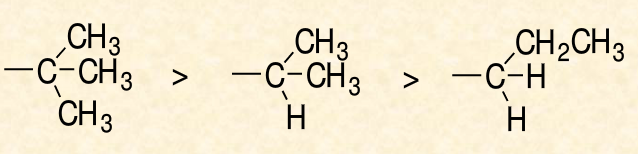
如甲基和乙基,甲基的第一個碳原子上連線了3個H原子,乙基的第一個碳原子連線了2個H原子和一個C原子,C的原子序數比H大,所以乙基為“較優”基團。
同理,如下圖,三級碳原子>二級碳原子>
一級碳原子 。
3.當與碳原子相連的是不飽和基團時,如羰基,
羧基 ,
羥基 ,
醛基 等看作是和O連了兩次,碳氮三鍵看作是和N連了三次。如下圖,故羧基>醛基>羥基
4.若與雙鍵碳原子相連的基團互為順反異構時,Z型先於E型。
5.若參與比較順序的原子的鍵不到4個,例如氮原子,則可以補充適量的原子序數為零的假想原子,假想原子的排序放在最後。例如CH3 CH=NCH3 ,這個N原子上除雙鍵外有一個甲基,則假設它的第二個基團為一個原子序數為0的假想原子CH3 ->假想原子。
常見基團次序表
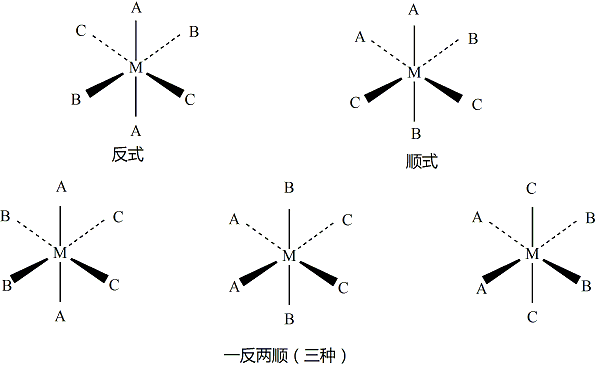
配合物的異構 配合物的多種異構現象,大部分是由於立體結構不同或內界組成和配位體的連線方式不同而引起的。配位體在中心原子周圍因排列方式不同而產生的異構現象,叫立體異構現象。順式指同種配位體處於相鄰位置,一般用“順”或“cis-”表示;反式指同種配體處於對角位置,一般用“反”或“trans-”表示。
對於配位數為2、3、4(四面體)的配位化合物來說不存在這種異構現象,因為這些空間結構中的配位位置是彼此相鄰的,沒有反位的現象存在。但對於平面正方形和正八面體配位化合物來說,順反異構現象則非常常見。
平面正方形配合物 平面正方形的[MA2 B2 ]類型配合物可有順式和反式兩種異構,如二氯·二氨合鉑[PtCl2 (NH3 )2 ]有下列兩種異構體:相同的配體Cl- 和NH3 處於順位位置,為順式異構體。相同的配體Cl和NH3 處於反式位置,為反式異構體。
有少數Pt的平面正方形配位化合物含有4種不同的配體,這種情況下就會有三種異構體存在,如[Pt(NH3 )NH2 OH(Py)(NO2 )]+ 配離子。這種情況就不能用簡單的順-反來表明,如下圖,命名時一般是把兩組反位的配體放在角括弧里。
正八面體配合物 配位數為6的八面體結構,其順反異構現象與平面正方形的情況類似,但情況較為複雜。
有兩種配體的[MAB5 ]型配位化合物,沒有幾何異構體存在。
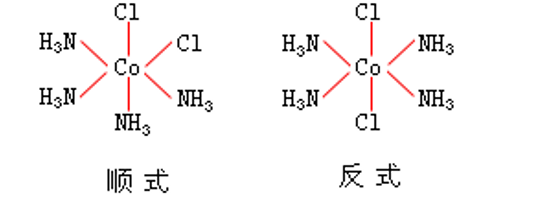
有兩種配體的[MA2 B4 ]型配位化合物,同樣存在順反異構現象,有兩種立體異構體,如下圖所示的[CoCl2 (NH3 )4 ]+ :
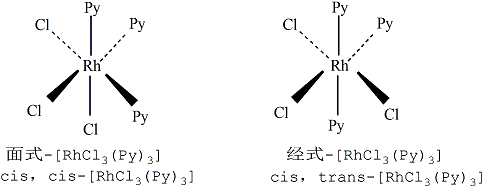
有兩種配體的[MA3 B3 ]型配位化合物,如[RhCl3 (Py)3 ]也有兩種異構體,將兩種配體各自連成相互平行的平面稱為面式異構體(順-順式異構體),用“cis,cis-”表示,反之若兩平面相互垂直則稱為經式異構體(順-反式異構體),用“cis,trans-”表示。
有三種配體的[MAB2 C3 ]型配位化合物有3種異構體。
有三種配體的[MA2 B2 C2 ]型配位化合物有5種異構體。
對於[MABCDEF]這樣的配位化合物應該有15種幾何異構體,唯一存在的此類配位化合物為[Pt(Py)(NH3 )(NO2 )(Cl)(Br)(I)],但目前只製得其中的三種。
性質差異 物理性質 順反異構體的物理性質有所不同,並表現出一些規律性,其中較顯著的有:
燃燒熱 、熔點、溶解度和偶極距。
熔點 :反式異構體中的原子排列比較對稱,分子能規則地排入
晶體結構 中,其分子所構成的晶體的分子間的
色散力 就越大,晶格能則越大,因而具有較高的熔點。
偶極距、沸點和溶解度 :一般來說,反式異構體的極性較小,儘管存在不同取代基時影響力不同,但仍可以部分抵消。而
順式異構體 中兩個
電負性 相同的原子或
原子團 處在分子的同側,不像反式那樣比較對稱地排列,則不能產生這種抵消,從而在矢量合力方向上產生一個偶極矩,因而順式分子的偶極距比反式大。偶極分子有微弱的極性,因此在弱極性的水中的溶解度也就比較大。分子極性越大,越類似離子型化合物,其分子間靜電相互作用力就越大,而分子間作用力就越大的順式異構體沸點越高。
燃燒熱 (heat of combustion):它是指一
摩爾 化合物完全燃燒生成二氧化碳和水所放出的熱量,其大小可反映分子能量的高低,所以常可作為有機物相對穩定性的根據。通常有機物越穩定,分子能量就越低,就具有較小的燃燒。因為反式較順式穩定,所以反式異構體的燃燒比順式小。
下表中歸納了順反丁烯二烴的熔點、溶解度和偶極距。
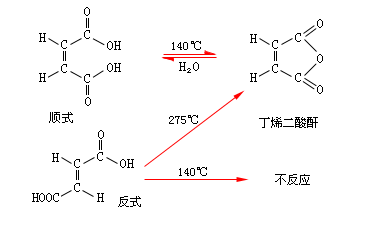
化學性質 例如,順-丁烯二酸的兩個羧基處在雙鍵的同側距離比較近而容易發生
脫水反應 。反式的兩個羧基即處在雙鍵的異側,距離較遠,在同樣溫度下不起反應。但如熱到較高的溫度,反式先轉變成順式再脫水生成
酸酐 。
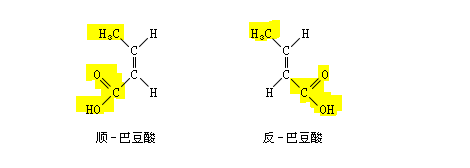
又如巴豆酸的兩個異構體,用甲醇酯化時,反-巴豆酸的酯化速度較快,因反式的甲基和羧基處在雙鍵的異側,空間位阻較小,容易酯化。順-巴豆酸的甲基和羧基處在雙鍵的同側,空間位阻較大,不易酯化。
紫外光譜 順反異構多指雙鍵或環上取代基在空間排列不同而形成的異構體。其紫外光譜有明顯差別,一般反式異構體電子離預範圍較大,鍵的張力較小,π—>π*躍遷位於長波端,吸收強度也較大。
反式
二苯乙烯 在乙醇溶液中出現3個吸收帶,最大吸收波長為201.5nm。而順式二苯乙烯在乙醇溶液中僅出現2條譜帶,這是由於反式比順式更加有效共軛。若α-甲基取代時,反式吸收帶比順式吸收帶位於長波端,但α,α'-二甲基取代時,反式比順式最大吸收波長位於較短波長端,這是由於這類化合物順式更利於共軛。
肉桂酸異構體的紫外吸收光譜也有很大不同。反式肉桂酸為平面型結構,雙鍵與處於同一平面的苯環容易π-π共軛。順式肉桂酸中由於空間位阻,雙鍵與苯環處於非平面,不易發生共軛。所以反式較順式最大吸收波長位於長波端,摩爾吸收係數最大值高於順式一倍。
紅外光譜 有機化合物的紅外光譜對於鑑別某種官能團的存在與否是相當有力的,而標誌某官能團的特徵吸收又與化合物的構造有著密切的聯繫,在有些場合,構造的差別甚至會使某一特徵吸收消失。
例如,1,2一
二氯乙烯 的V
c=c 吸收對於順、 反異構體來講是截然不同的:
反式1,2一二氯乙烯 Vc=c 無順式1,2一二氯乙烯 Vc=c 1590cm-1 (s)
這是因為反式異構體是一個對稱的分子,μ=0。而這樣的分子在紅外光譜學中稱為“紅外失活的”,所以不產生吸收。這種對稱性的影響在烯類化合物中的反映是比較明顯的。如丙烯(CH3 CH=CH2 )這種不對稱取代的烯可產生強的Vc=c 吸收,而2—丁烯(CH3 CH=CHCH3 )其反式(Vc=c 1675cm-1 )比順式(Vc=c 1660cm-1 )的吸收波數稍高一些,但強度卻相反,以致用該峰鑑別順、反異構體無意義。但可借雙鍵上所連氫的面外彎曲振動吸收來區別,這個峰在二者的鑑別上是相當有價值的。反式的面外吸收為1000-950cm-1 , 而順式的為725-675cm-1 。
互相轉換 在順反異構體中,通常是反式比較穩定,而順式較不穩定。
如將順式異構體加熱或受日光的作用,就容易轉變成較穩定的
反式異構體 。例如順-丁烯二酸加熱就可轉變
成反-丁烯二酸。
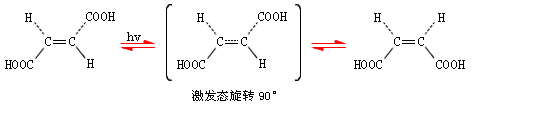
而反-丁烯二酸轉變為順式異構體較困難,比較好的方法是用紫外光照射,在紫外光照射下反式異構體吸收能量轉變為順式異構體,產品中通常存在順式和反式混合物。
分析測定方法 高效液相色譜法 HPLC法在順反異構體藥物的分離分析中套用廣泛,其可與多種檢測器聯用,在分離分析高沸點、大分子、熱穩定性差的化合物方面具有極大優勢,而其對順反異構體的分離選擇性和檢測精確度主要取決於選用合適的色譜柱和檢測器。
毛細管電泳法 CE法對帶電荷物質的分離效果顯著,但有時為改善峰形或提高分離度,需在測試樣品中添加合適的添加劑,如十二烷基磺酸鈉(SDS)、β-環糊精等,或採用非水CE法。胡琴等(中國藥學雜誌,2001年)採用未塗層石英毛細管柱,以含0.5%羥丙基β-環糊精的50mmol·L
-1 磷酸二氫鈉 溶液(pH2.5)為運行緩衝液,於297nm波長下,分離檢測鹽酸多塞平的Z/E-異構體,其檢測結果與HPLC法所得結果相近。隨後,該研究小組又建立了非水CE法分離鹽酸多塞平異構體,緩衝液為加入3.0%冰醋酸200mmol·L
-1 醋酸銨的甲醇-乙腈(95∶5)溶液,無需使用任何在毛細管區帶電泳分離異構體時常用的添加劑即可在12min內完成分析,分析速度更快。
氣相色譜法 GC法分離效率高,樣品用量少,選擇性好,可分離分析順反異構體、旋光異構體等,常用於在實驗溫度下可氣化且性質穩定的物質的分析,對於那些熱不穩定或難以氣化的物質,可通過化學衍生化方法使其達到GC分析的要求。多塞平的Z-和E-異構體具有不同的沸點,可選擇GC法對二者進行分離,但因填充柱對多塞平存在吸附作用,使得色譜峰峰形較差,故研究者常選擇使用毛細管色譜柱採用程式升溫法,將HP-1毛細管柱溫自起始溫度90℃以30℃/min-1 的速度升至200℃,然後以10℃/min-1 的速度升至280℃,使馬子宮和血漿中的多塞平及其代謝物的異構體在短短六分鐘內得到分離。
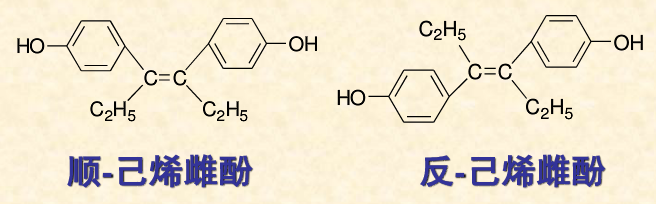
活性套用 活性不同 人工合成的
乙烯雌酚 是一種雌性激素,反式構型的生物活性比順式構型的高7~10倍。
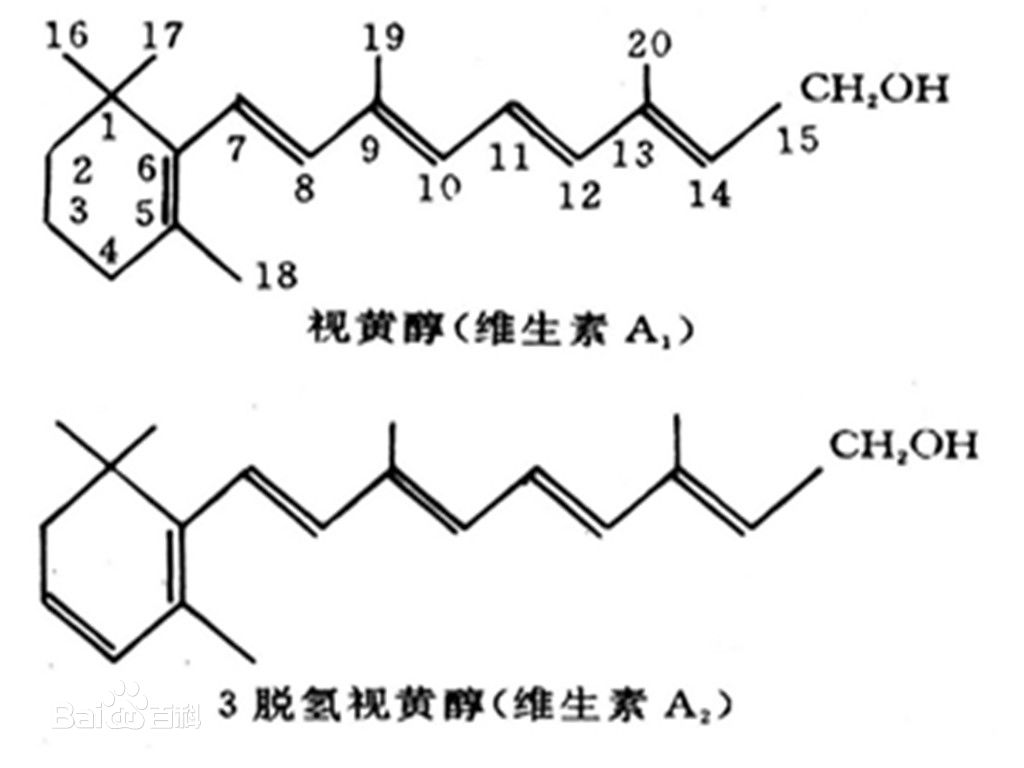
維生素A分子中所有的雙鍵全部都為反式構型。
具有降血脂作用的亞油酸及花生四烯酸分子的碳碳雙鍵都是順式構型。若改變上述化合物的構型,將導致生理活性的降低甚至喪失。
[PtCl2 (NH3 )2 ]的順-反異構體都是平面正方形,兩者性質卻不同,甚至在人體內的生理、病理作用也有所不同,如現已發現順式[PtCl2 (NH3 )2 ]具有抑制腫瘤的作用,可作抗癌藥物,而反式[PtCl2 (NH3 )2 ]則無此活性。
藥效不同 非甾體
抗雌激素 類藥物他莫昔芬的2種構型具有完全相反的藥理作用,其Z-異構體具有抗雌激素的作用,E-異構體則為雌激素興奮劑。
氯哌噻噸 的E-異構體可用作安定劑,而Z-異構體具有抗菌作用,對中樞神經疾病則無效。