非極性分子相互靠攏時,它們的瞬時偶極矩之間會產生很弱的吸引力,這種吸引力稱為色散力。色散力存在於一切分子之間。
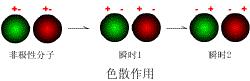
任何一個分子,都存在著瞬間偶極,這種瞬間偶極也會誘導鄰近分子產生瞬間偶極,於是兩個分子可以靠瞬間偶極相互吸引在一起。這種瞬間偶極產生的作用力稱為色散力(dispersion force)。色散力是倫敦(London)於1930年根據近代量子力學方法證明的,由於從量子力學導出的理論公式與光色散公式相似,因此把這種作用稱為色散力,又叫做倫敦力。
基本介紹
- 中文名:色散力
- 外文名:dispersion force
- 概述:非極性分子相互靠攏時
- 緣由:分子中電子和原子核不停地運動
- 范德華力:色散力、誘導力和取向力
- 性質:鹵素分子物理很容易分子間力定性
定義,緣由,范德華力,性質,
定義
定義
任何一個分子,由於電子的不斷運動和原子核的不斷振動,常發生電子云和原子核之 間的瞬時相對位移,從而產生瞬時偶極。分子靠瞬時偶極而相互吸引,這種力稱為色散 力。色散力主要與分子的變形性有關,分子的變形性越大,色散力越強。它存在於一切分 子之間。
緣由
由於分子中電子和原子核不停地運動,非極性分子的電子云的分布呈現有漲有落的狀態,從而使它與原子核之間出現瞬時相對位移,產生了瞬時偶極,分子也因而發生變形。分子中電子數愈多、原子數愈多、原子半徑愈大,分子愈易變形。瞬時偶極可使其相鄰的另一非極性分子產生瞬時誘導偶極,且兩個瞬時偶極總採取異極相鄰狀態,這種隨時產生的分子瞬時偶極間的作用力為色散力(因其作用能表達式與光的色散公式相似而得名)。雖然瞬時偶極存在暫短,但異極相鄰狀態卻此起彼伏,不斷重複,因此分子間始終存在著色散力。無疑,色散力不僅存在於非極性分子間,也存在於極性分子間以及極性與非極性分子間。
量子力學計算表明,色散力與分子變形性有關,變形性越大,色散力越強。由於各種分子均有瞬間偶極,所以色散力存在於極性分子和極性分子、極性分子和非極性分子以及非極性分子和非極性分子之間。而且在一般情況下,色散力是主要的分子間力。只有極性相當強的分子,取向力才顯得重要。
分子間力是一種永遠存在於分子間的作用力。由於隨著分子間距離的增大而迅速減小,所以它是一種近程力,表現為分子間近距離的吸引力,作用範圍只有幾個皮米。其作用能的大小從幾到幾十焦耳每摩爾,比化學鍵的鍵能小1~2個數量級。與共價鍵不同,分子間力沒有方向性和飽和性。分子間力包括三種作用力,由於相互作用的分子不同,這三種力所占的比例也不同,但色散力通常是最主要的