正電荷通過不在烯丙基位上的雙鍵或三鍵甚至單鍵而發生離域的碳正離子,又稱碳鎰離子,是一個通過閉合多中心鍵分布正電荷的離域碳正離子,其碳原子呈五價,是二電子三中心鍵。
基本介紹
- 中文名:非碳正離子
- 外文名:Nonclassical carbocation
非碳正離子的提出
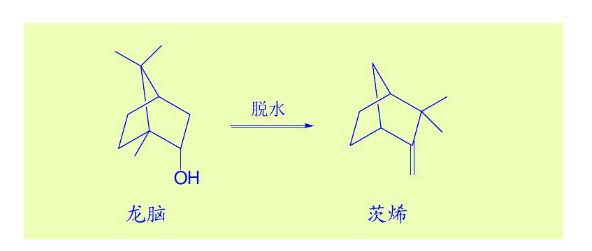
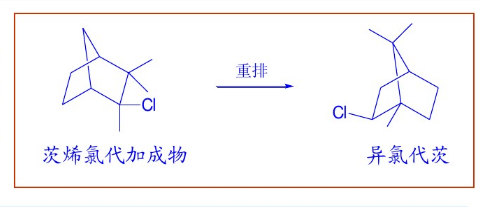
非碳正離子定義
與碳正離子的區別


非碳正離子的形成

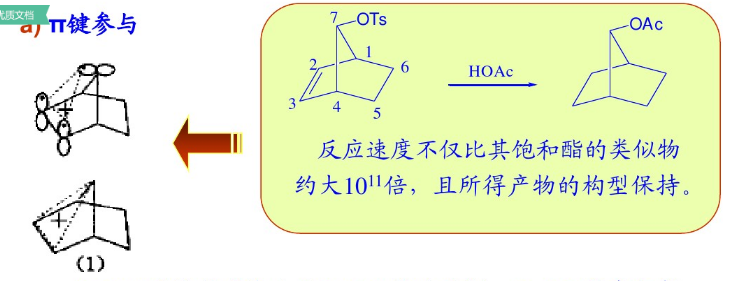
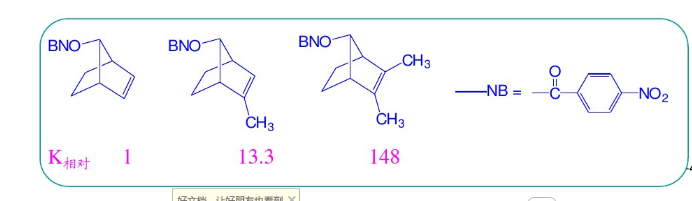



重要的相關知識-碳正離子
定義
結構和生成
 碳正離子
碳正離子
正電荷通過不在烯丙基位上的雙鍵或三鍵甚至單鍵而發生離域的碳正離子,又稱碳鎰離子,是一個通過閉合多中心鍵分布正電荷的離域碳正離子,其碳原子呈五價,是二電子三中心鍵。










 碳正離子
碳正離子正電荷通過不在烯丙基位上的雙鍵或三鍵甚至單鍵而發生離域的碳正離子,又稱碳鎰離子,是一個通過閉合多中心鍵分布正電荷的離域碳正離子,其碳原子呈五價,是二...
非經典碳正離子的類型 碳正離子 類型 含有橋形結構的碳正離子被定義為非經典碳正離子,即包含一個三中心二電子鍵和一個超共價原子的橋形結構。CH5+是典型的非...
碳正離子(Carbenium ion)是一種帶正電的不穩定的有機物。與自由基一樣,是一個活潑的中間體,有一個正電荷,最外層有6個電子。經典的碳正離子是平面結構。帶...
韭經典碳正離子nonclaasic:nV car6ocatton tI.電荷分散到 3個碳原子上所生成的二電子三中心鍵體系。由 溫斯坦f5. V4'einstei司提出並用以解釋降冰片基正 離子...
苄基正離子是碳正離子的一種,是一種帶正電的不穩定的有機物。與苄基自由基一樣,是一個活潑的中間體,有一個正電荷,最外層有6個電子。...
碳正離子可以發生重排反應.在重排時,一個有機基團或一個氫原子帶其一對電子遷移到缺電子碳上,這樣就在基團轉移離去的碳原子上產生了一個新的碳正離子中心。...
芳正離子是碳正離子的一種,其中π電子數符合休克爾(Hückel)規則的環狀正離子稱為芳正離子,為有機合成反應過程中的中間體,不能穩定存在。...
碳正離子的穩定性有其規律:凡與共軛體系相連的碳正離子總比非共軛體系更穩定,因而也更容易產生。然而分散了正電荷的非經典碳正離子的親電活性較經典碳正離子有所...
喬治·安德魯·歐拉(George Andrew Olah,Oláh György)(1927年5月22日-),出生於布達佩斯,是一個美籍匈牙利化學家。他在超強酸穩定碳正離子的研究中有傑出貢獻。...
非經典碳正離子 Anchimeric assistance 研究領域 物理有機化學領域 學生 理察·赫克 紹爾·溫施泰因(Saul Winstein)1912年10月8日—1969年11月23日,加拿大...
非經典碳正離子,比如降冰片烷陽離子。一些常見的酸,比如氯酸、磷酸、硫酸等。超價分子N-X-L命名 超價分子的N-X-L命名法在1960年提出,經常用於區分超價分子...
10 1 7藉助π鍵和σ鍵的鄰基參與:非經典碳正離子20010 1 8SNi機理20610 1 9烯丙位碳上的親核取代:烯丙位重排20610 1 10三角形脂肪碳上的親核取代:...
非經典碳正離子中碳的正電荷不只定域在一個原子上,含有三中心兩電子鍵,碳的配位數也因此從3增大到4或5。一個例子是降冰片基正離子。...
4 1碳正離子1534 1 1構型和產生1534 1 2相對穩定性1554 1 3非經典碳正離子1614 1 4反應模式1654 2碳負離子1654 2 1構型和產生165...
《物理有機化學》是2009年化學工業出版社出版的圖書,作者是英柏寧。全書共分十三章,包括:有機化學中的價鍵和更弱的化學鍵,線性自由能關係,有機酸鹼,碳正離子...
2.3碳正離子法0382.3.1非經典碳正離子0382.3.2烷基碳正離子:Friedel Crafts烷基化反應0382.3.3醯基碳正離子:Friedel Crafts醯基化反應040...
第一節碳正離子51一、碳正離子的結構51二、碳正離子的生成52三、碳正離子的穩定性及其影響因素52四、碳正離子的反應54五、非經典的碳正離子55第二節碳負離子...
《物理有機化學》是2009年化學工業出版社出版的圖書,作者是英柏寧。全書共分十三章,包括:有機化學中的價鍵和更弱的化學鍵,線性自由能關係,有機酸鹼,碳正離子...
5 1 2穩定性和結構1045 1 3非典型碳正離子1075 1 4碳正離子的產生和湮滅1075 2碳負離子1085 2 1穩定性和結構1085 2 2金屬有機化合物的結構111...
第一節碳正離子49 一、碳正離子的結構49 二、碳正離子的生成49 三、碳正離子的穩定性及其影響因素50 四、碳正離子的反應52 五、非經典的碳正離子53 第二節...
非經典碳正離子中碳的正電荷不只定域在一個原子上,含有三中心兩電子鍵,碳的配位數也因此從3增大到4或5。一個例子是降冰片基正離子。...
4 1 3非經典碳正離子1614 1 4反應模式1654 2碳負離子1654 2 1構型和產生1654 2 2相對穩定性1694 2 3反應模式1714 2 4碳負離子和互變異構1714 3...
4 2親核取代反應的機理514 3碳正離子與非經典碳正離子524 4影響親核取代反應速率的因素544 5親核取代反應的立體化學554 6親核試劑的類型和反應58習題59...
4 3碳正離子與非經典碳正離子58 4 4影響親核取代反應速率的因素60 4 5鄰基參與作用61 4 6親核試劑的類型和反應65 習題65 第5章加成與消除反應69 ...
4.2親核取代反應的機理574.3碳正離子與非經典碳正離子584.4影響親核取代反應速率的因素604.5鄰基參與作用614.6親核試劑的類型和反應65習題65第5章加成與消除反應69...
活性中間體 在有機反應中,反應物分子往往先形成碳正離子、碳負離子、游離基、...當親核試劑進攻時,它可以進攻非經典碳正離子的任何一個可能的區域。...
