基本介紹
- 中文名:芳正離子
- 外文名:aryl cation
- 穩定性:不穩定
定義,碳正離子的生成與分類,環狀碳正離子的穩定性,實際套用,
定義
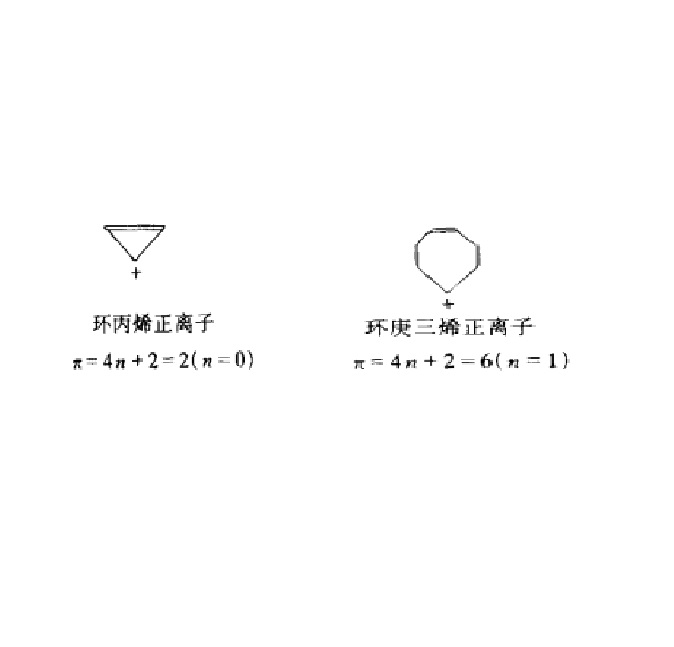
芳正離子是碳正離子的一種,其中π電子數符合休克爾(Hückel)規則的環狀正離子稱為芳正離子,如圖。
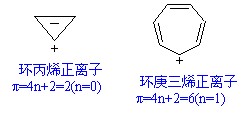 芳正離子
芳正離子碳正離子的生成與分類
在有機化學反應中,碳正離子的產生主要有直接離子化、間接離子化以及其它的生成途徑。直接離子化是指在化合物的離解過程中,離去基團帶著一對電子離去,產生碳正離子,是以共價鍵的異裂方式產生碳正離子的。鹵代烴的異裂就是直接離子化的一個典型的例子。在這個反應中,極性溶劑的溶劑化作用對碳正離子的生成起重要作用。在Brönsted酸或Lewis酸的催化下,醇、醚、醯鹵等也可以直接離解為碳正離子。間接離子化是指正離子與中性分子發生加成而產生新的碳正離子,最常見的有芳環上的親電取代反應和烯烴的親電加成反應。其它生成途徑是指由較容易獲得的碳正離子轉換成較難獲得的碳正離子,常見的有重氮基正離子脫氮氣而生成新的碳正離子。
作為有機化學反應活性中間體的碳正離子有很多,根據不同的分類標準,可以對其進行如下不同的歸類。一、按碳正離子所連線的基團及所處的位置分類:(1)鏈狀碳正離子,包括非共軛型碳正離子和共軛型碳正離子。非共軛型碳正離子的正電荷集中於中心碳原子上,最常見的為烷基碳正離子,如甲基正離子。共軛型碳正離子的正電荷離域到整個共軛體系中,而不再集中於中心碳原子上。這是由於中心碳原子的p軌道與不飽和鍵上的π鍵發生共軛,如烯丙基正離子。(2)環狀碳正離子,如苯基正離子、環戊二烯基正離子。二、據中心碳原子所連基團的多少分為伯、仲、叔碳正離子,如乙基正離子、異丙基正離子、叔丁基正離子。三、非經典碳正離子。這類碳正離子通常是由經典碳正離子轉化而成的。在該類碳正離子中,σ鍵的電荷不只定域在一個原子上,而是形成三中心兩電子鍵。“非經典離子”這個詞語一開始是由Roberts用來描述基正離子的。
環狀碳正離子的穩定性
環烷基正離子的穩定性順序為環丙基正離子< 環丁基正離子< 環戊基正離子< 環己基正離子。這主要是因為隨著環上碳原子數量的增加,C-C-C 鍵角逐漸增加,環張力減小。環丙基正離子要比異丙基正離子穩定 6.9 kcal/mol。這可能是環丙烷分子中的重疊張力消失的結果。
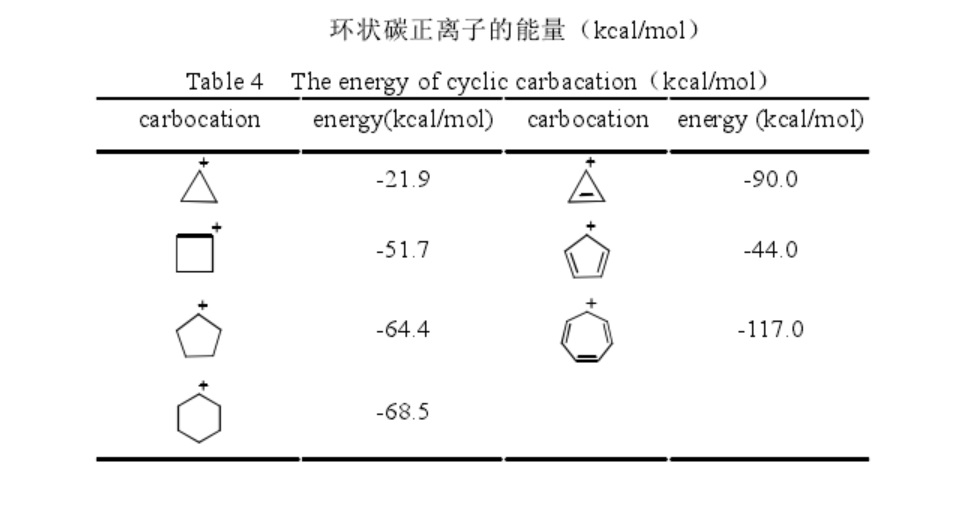 環狀碳正離子的能量
環狀碳正離子的能量因為三點確定一個面,所以環丙烷的三個碳原子必須在同一平面上,碳原子核連線之間的夾角應為 60°。若環碳原子以 sp3的形式雜化,則分子軌道之間的正常角度應為 109°28′。因此在形成環丙烷時,可以有兩種選擇:一種是保持正常軌道 109°,軌道彼此間電子的排斥最小(正四面體),但這樣就會使兩個軌道重疊得非常不好。另一種是不管軌道間的電子排斥,而使軌道的軸和碳原子之間的軸在同一直線上,以達到最大的重疊。而實際上測得環丙烷分子的 C−C−C 鍵角為 105°30′,H−C−H 的鍵角為 115°,C−C 鍵長和 C−H 鍵長分別是 151.0 pm 和108.9 pm。這說明,為了使分子的能量達到最合適的程度,實際上環丙烷中的價鍵是這兩種成鍵方式協調的一個結果,也就是既大略地保持原來軌道間的角度,又達到一定程度重疊而形成一個彎曲的鍵或稱為香蕉鍵。因此環丙烷的碳碳單鍵比一般碳碳單鍵的鍵長(154pm)要短。由於三個碳原子形成了環,所以六個氫原子都形成重疊型,並且是均等的。這樣就存在著很強的重疊張力。環丙基正離子中也存在著這種特殊的香蕉鍵,但由於失去了一個氫,在環丙烷中存在的很強的重疊張力卻減弱了,但是角張力卻更大了。
之前的報導顯示環戊二烯基正離子能量要比甲基正離子的能量低,但是卻比環丙烯基正離子和環庚三烯基正離子的能量高很多。當空的 p 軌道是共軛環體系的一部分時,會促進碳正離子的穩定,本文的計算結果確證了上述結論。環丙烯基正離子的能量為-90.0 kcal/mol,環庚三烯基正離子的能量為-114.0 kcal/mol。這兩個碳正離子的原子均在一個平面且鍵長分別相等,正電荷平均分散在每個碳原子上。根據休克爾規則, 可以判斷出環丙烯基正離子和環庚三烯基正離子均具有芳香性。計算結果也可以確證這一點,環丙烯基正離子的能量要比烯丙基正離子的能量低 35.3 kcal/mol,環庚三烯基正離子的能量要比庚三烯基正離子的能量低 25.0 kcal/mol。之前的理論研究認為環戊二烯基正離子是反芳香性的。然而,本文的計算結果表明環戊二烯基正離子具有非芳香性結構,反芳香性只是一個過渡態。環戊二烯基正離子中的 C−C 鍵的鍵長有很大的區別。C2−C3 單鍵的鍵長為 1.575 Å, 這要比正常的 Csp3−Csp3鍵的鍵長 (1.540 Å) 和 Csp2−Csp2鍵的鍵長 (1.470 Å)都長。也就是說環戊二烯基正離子中的 C2−C3 單鍵很微弱。然而 C1−C2 鍵的鍵長和 C3−C4 鍵的鍵長為 1.366 Å ,C1−C5 鍵的鍵長和 C4−C5 鍵的鍵長均為 1.455 Å。這種多樣化的鍵長表明環戊二烯基正離子為了避免形成一個 4π 電子環流(所謂的反芳香體系)而形成一個非常微弱的,較長的 σ 鍵,最終使得結構發生很大的變化。環戊二烯基正離子的鍵長並未平均化且正電荷沒有平均分散,這樣無法形成電子環流,不符合反芳香性的定義。所以,本文認為環戊二烯基正離子是非芳香性的。σ 鍵的拉長導致環戊二烯基正離子的能量比 1,4-戊二烯基正離子(CH2=CH-+CHCH=CH2)的能量高 35.3 kcal/mol。
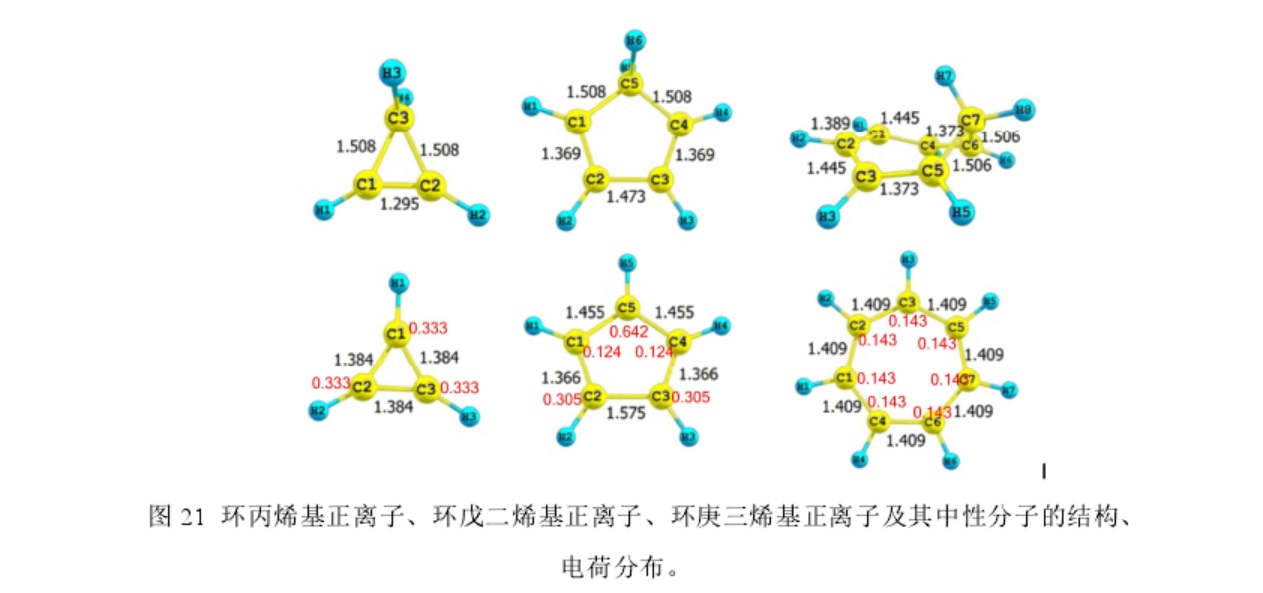 離子及其中性分子的結構、 電荷分布。
離子及其中性分子的結構、 電荷分布。實際套用
萘環的取代定位規律當親電試劑E+進攻萘環時可以生成α位和β位兩種芳正離子,它們都可以看作是五個共振結構雜化的結果。
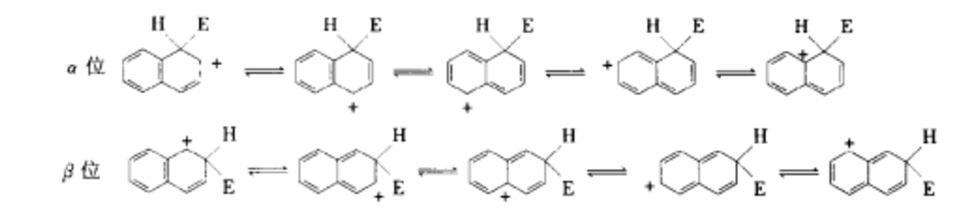
在α芳正離子中有兩個共振結構保留了穩定性較高的苯型結構,而在β芳正離子中只有一個共振結構保留了穩定性較高的苯型結構,所以α芳正離子比β芳正離子較穩定,即α位比β位活潑。E+優先進攻α位。另外,α和β芳正離子都可以把正電荷分散到更廣的範圍,增加它們的穩定性,所以萘的α位和β位都比苯活潑。