基本介紹
- 中文名:電化學沉積
- 外文名:Electrochemical deposition
- 理論基礎:物理化學與電化學
- 反應類型:氧化還原反應
- 反應實質:正負離子的遷移並發生得失電子
- 特點:產品的質量較好
電化學沉積的特點
定位電化學沉積設備
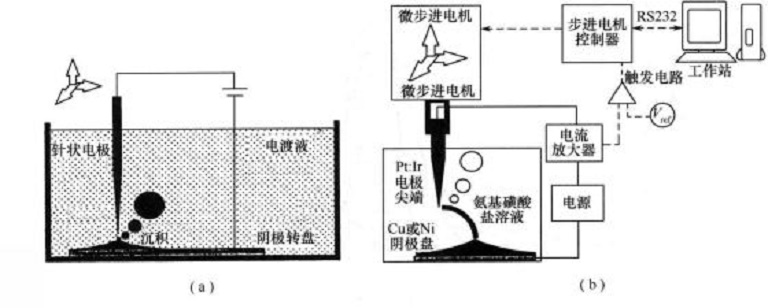
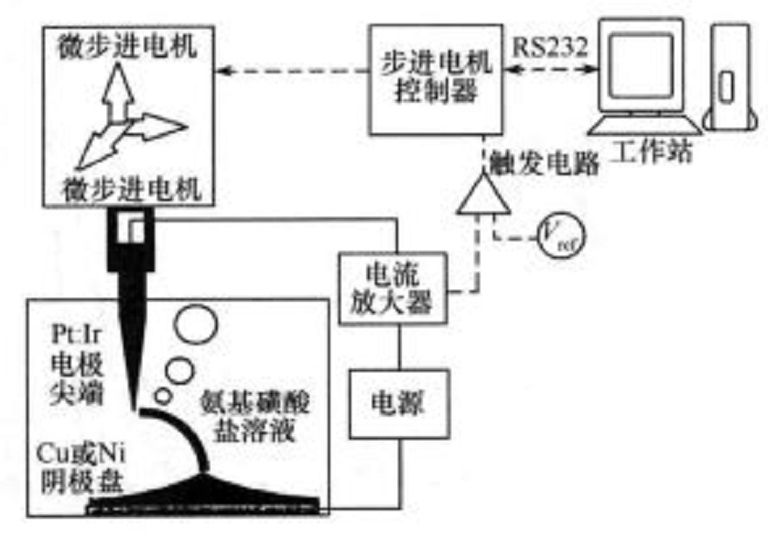

電化學是研究化學現象與電現象之間的相互關係以及化學能與電能相互轉化規律的學科。電化學沉積是指在外電場作用下電流通過電解質溶液中正負離子的遷移並在電極上發生得失電子的氧化還原反應而形成鍍層的技術。在陰極產生金屬離子的還原而...
電沉積是指金屬或合金從其化合物水溶液、非水溶液或熔鹽中電化學沉積的過程。是金屬電解冶煉、電解精煉、電鍍、電鑄過程的基礎。這些過程在一定的電解質和操作條件下進行,金屬電沉積的難易程度以及沉積物的形態與沉積金屬的性質有關,也...
電共沉積,是一種電化學過程。電沉積單一金屬技術已經比較成熟。電沉積是建立在電化學理論基礎上的成膜技術。通過電沉積技術在材料表面獲得具有一定功能的膜層,是一種歷史較長、工藝相對成熟的表面處理技術。電沉積方法的研究進展 電沉積...
其基本過程是在孔基片的兩邊分別通以金屬鹵化物和含氧氣流,在高溫低壓下完成電化學沉積。研究過程 Tsutomaloroi利用EVD法將YSZ沉積到多孔的LaSrMnO₃基片上,形成固體電解質薄膜,製備出SOFC陰極支撐的電解質薄膜。Etsell等人提出了極化...
《電化學氣相沉積機理的研究》是依託北京科技大學,由魏秋明擔任項目負責人的青年科學基金項目。項目摘要 本研究對於高溫固體氧化物燃料電池(簡寫為SOFC)的多孔陶瓷支撐管,猛酸鍶鑭陰極材料和氧化物固體電解質膜的EVD製造技術和基礎進行了...
《地下結構混凝土電化學沉積修復界面性能及其細觀模型》是依託同濟大學,由陳慶擔任項目負責人的青年科學基金項目。中文摘要 地下結構由於受岩土體和地下水等複雜地下環境的作用,保持其良好的健康服役狀態非常困難,極有必要開發適合於地下水...
《電化學沉積過程的單一事體研究》是依託廈門大學,由毛秉偉擔任項目負責人的青年科學基金項目。項目摘要 本項目以微電極技術為研究手段,利用提出的“電位脈衝干預法““和電化學放大及應”為依據,研究了銀和金微電極上電沉積的行為。在...
《常溫電化學法沉積矽薄膜並部分晶化以製備太陽能電池》是依託蘇州大學,由邵名望擔任項目負責人的重大研究計畫。項目摘要 摘要:非晶矽太陽能電池因可大規模生產、成本低廉等眾多優點有著廣闊的套用前景,但前期投資成本高和光致衰減效應成...
沉積電位在單晶表面比在多晶表面要顯著得多。定義簡介 在電化學測試中,循環伏安上的峰通常都是擴散控制引起的,在這個電位附近進行沉積時其電位並非沉積電位,而是要通過數學方法找到最佳沉積電位。一般是做極化曲線,在斜率迅速增大的那段...
研究將以電化學沉積製備不同納米複合結構RGO/ZnO-SnO2膜,用氧化石墨膠體和電解質溶液的混合液為電沉積液,利用沉積過程中的電化學反應形成複合結構。通過製備不同結構複合納米膜,研究不同結構RGO的能帶結構和光吸收性、導電性、光電性能...
超薄錳層有特殊的物理化學性質,有廣泛的套用前景。近年來,在異質金屬基體上沉積超薄錳層的實驗與理論研究已成為熱點。目前報導的製備超薄錳層的方法主要是物理氣相沉積法。本項目擬開展採用高效、廉價和簡單的電化學沉積法製備超薄Mn/金屬...
電化學是研究兩類導體形成的帶電界面現象及其上所發生的變化的科學。電和化學反應相互作用可通過電池來完成,也可利用高壓靜電放電來實現(如氧通過無聲放電管轉變為臭氧),二者統稱電化學,後者為電化學的一個分支,稱放電化學。由於...
由於矽基表面在水溶液或空氣中易被氧化而失去本徵有序結構,使得利用電化學法在單晶矽上製備外延結構具有很大的挑戰性和難度。 本課題通過將單晶Si(111)表面進行甲基化修飾獲得在溶液電化學條件下穩定存在的有序結構,利用電沉積製備得到半...
《AuSn20共晶電沉積中錫可控析出的配體作用機制及設計原則》是依託中山大學,由崔國峰擔任項目負責人的面上項目。中文摘要 AuSn20共晶釺焊過程中,錫含量低於20wt%,其熔點將顯著升高,導致封裝失效。本項目採用電化學沉積法製備AuSn20共晶...
欠電位沉積(Underpotential Deposition,縮寫UPD)是指一種金屬可在比其熱力學可逆電位正的電位下沉積在另一基體上的現象,是一個與電極/溶液結構密切相關的重要的電化學現象。技術原理 迄今為止,已報導了大量UPD實驗現象。認為當沉積原子...
適讀人群 :從事表面改性、電鍍、電化學等領域的科研與工程技術人員,相關專業的在校師生 (1)本書系統地介紹了納米晶鎳基合金電沉積和鎳基合金複合電沉積技術。內容先進,實用性強,具有較高的參考價值。(2)本書詳細介紹了工藝條件...
2.2 金屬離子沉積的電化學過程 2.2.1 傳質過程 2.2.2 界面反應 2.3 電沉積結晶生長過程 2.3.1 電沉積結晶形核 2.3.2 螺旋位錯生長 2.3.3 電沉積結晶生長 2.4 電沉積膜層的形態和外延 2.4.1 電沉積膜層的形態 2....
系統研究溶液和電化學條件對外延薄膜表面和界面結構的影響及內在機制,最佳化條件,獲得高質量的同質結外延薄膜。 研究建立同質結外延薄膜的表面/界面結構和太陽能轉化效率的關係。 通過本項目的研究將為製備無毒、高效率及低成本的氧化物薄...
氧化亞銅(Cu2O)是一種禁頻寬度為2.0 eV的p型半導體材料,在太陽能光分解水中非常具有套用潛力,但是由於熱力學和動力學方面的原因,其在水溶液中光電化學反應時的材料穩定性很差。本項目利用電化學沉積方法製備納米立體結構的Cu2O薄膜...
設計併合成出適合活潑金屬鋁和鈦電沉積的電化學視窗寬、黏度小、電導率大、對水和空氣穩定的離子液體,並對其性質進行綜合測定,驗證鋁和鈦在所得離子液體中的電積特性,掌握適合活潑金屬電沉積離子液體的設計準則。
1.4 CZTS前驅物的電沉積3 1.5 CZTS前驅物的硫化4 1.6 CZTS薄膜的光電性能測試4 1.7本研究的主要任務5 1.8本書的結構5 參考文獻6 第2章金屬前驅物的電極沉積8 2.1電化學沉積(電沉積)8 2.1.1電化學電池和沉積反應8 2...
4.6 電化學結晶-金屬的沉積與溶解 4.6.1 金屬沉積的簡單模型 4.6.2 螺旋位錯存在下的晶體生長 4.6.3 欠電勢沉積 4.6.4 金屬溶解與鈍化的反應動力學 4.6.5 電化學材料科學與電化學表面技術 4.7 混合電極與腐蝕 4.7.1 ...
electrochemical deposition 電化學澱積 ; 電化學沉積 ; 電沉積 ; 電化學沉積英語 laser deposition 雷射沉積系統 ; [冶] 雷射沉積 ; 雷射沉積法 Acid deposition 酸沉降 ; 酸性沈降 ; 酸性沉降 ; 酸性沉降物 atmospheric deposition ...
(1)顆粒電荷中和:由於顆粒接觸電極穩定下來,所帶電荷發生中和而沉積。這一機理對於單層沉積是重要的,如鹽類懸浮液中粉體的沉積;(2)顆粒電化學混凝:顆粒間的斥力降低,顆粒周圍電解質濃度提高,導致顆粒凝結;(3)顆粒積聚引起...
電鍍過程是鍍液中的金屬離子在外電場的作用下,經電極反應還原成金屬原子,並在陰極上進行金屬沉積的過程。因此,這是一個包括液相傳質、電化學反應和電結晶等步驟的金屬電沉積過程。在盛有電鍍液的鍍槽中,經過清理和特殊預處理的待鍍...
