某種離子傳遞的電荷與總電荷之比,稱為離子遷移數。若兩種離子遷移數傳遞的電荷分別為q+和q-,則通過的總電荷為:Q=q++q-,正、負離子的遷移數為:t+=q+/Q和t-=q-/Q,t++t-=1。離子遷移數可以直接測定,方法有希托夫法、界面移動法和電動勢法等。
基本介紹
- 中文名:離子遷移數
- 外文名:Ion transference number
- 學科:物理化學
- 表示:以百分數表示%
基本概念
影響因素
離子遷移數的測定
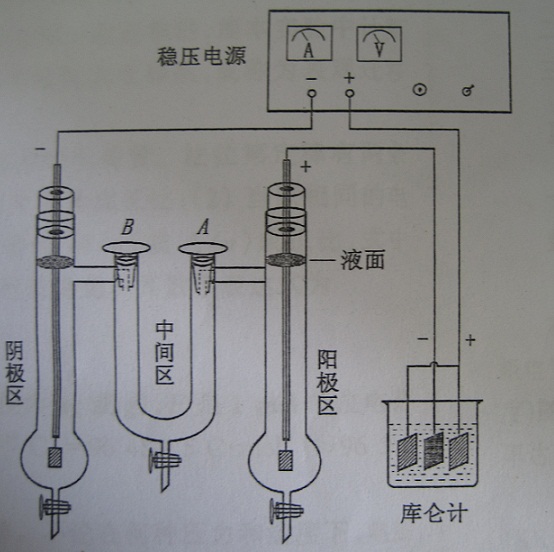
測定原理
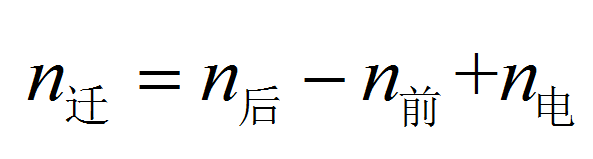
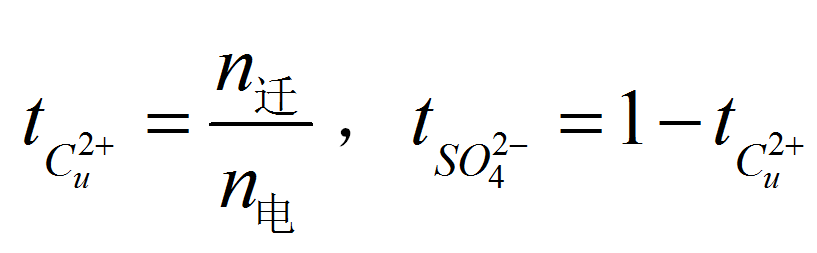
測試假定
儀器與試劑
測定步驟

某種離子傳遞的電荷與總電荷之比,稱為離子遷移數。若兩種離子遷移數傳遞的電荷分別為q+和q-,則通過的總電荷為:Q=q++q-,正、負離子的遷移數為:t+=q+/Q和t-=q-/Q,t++t-=1。離子遷移數可以直接測定,方法有希托夫法、界面移動法和電動勢法等。
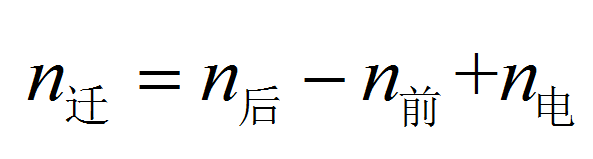
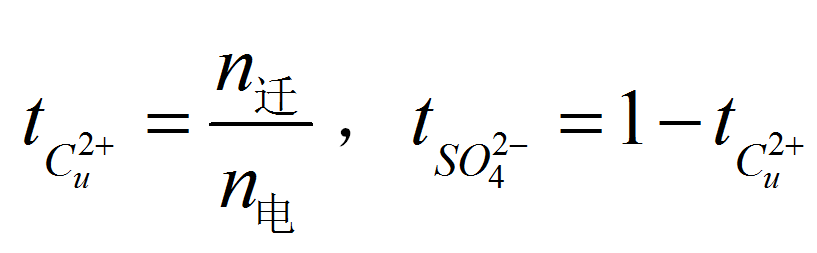

某種離子傳遞的電荷與總電荷之比,稱為離子遷移數。若兩種離子遷移數傳遞的電荷分別為q+和q-,則通過的總電荷為:Q=q++q-,正、負離子的遷移數為:t+=q+/Q...
導體中載流子的導電份額或百分數。如金屬中的電子承擔全部電份額,金屬離子不參與導電,則電子的遷移數為1;金屬離子為零。...
通常規定25C,於0.1mol/L KCL溶液或0.1mol/L NaCL溶液中測定的膜電導作為比較標準4、選擇透過性反映膜對不同離子的選擇透過能力,用離子遷移數(t)和膜的透...
配位數的大小直接影響離子遷移的難易。一般配位數愈小,離子愈易遷移。 不論是骨架離子或遷移離子,都希望能有較大的極化率,因為極化率表征離子的可變形性,極化...
如兩個Cl-濃度不同的Ag-AgCl電極組成的電池。因電池中有液體接界故存在離子越過液體接界處的遷移。電池電動勢不僅與溶液濃度有關,還與離子遷移數有關。...
實驗中分別採用三種輻射強度去處理膜,以確定輻射劑量對膜性能的影響,然後通過鹽擴散、交流電阻分析來測定膜的滲透性、電阻、離子遷移數、離子選擇透過性,並通過不同...
9.1.6鋰離子遷移數209 9.1.7電化學穩定性211 9.1.8小結212 9.2全固態鋰聚合物電池的製備213 9.2.1引言213 9.2.2SPE離子電導率的要求213 9.2.3傳統...
7.2 離子的遷移數1.離子遷移數的定義2.離子遷移數的測定方法7.3 電導、電導率和摩爾電導率1.定義2.電導的測定3.摩爾電導率與濃度的關係...
8.3離子的電遷移8.3.1離子的電遷移率8.3.2離子的遷移數8.3.3離子遷移數的測定8.4電解質溶液的導電能力8.4.1電導與電導率8.4.2摩爾電導率8.4.3摩爾電導率的測定...
8.3 離子的電遷移 8.3.1 離子的電遷移率 8.3.2 離子的遷移數 8.3.3 離子遷移數的測定 8.4 電解質溶液的導電能力 8.4.1 電導與電導率 8.4.2 摩爾電導率 8....
8.2離子的電遷移率和遷移數 離子的電遷移現象 離子的電遷移率和遷移數 離子遷移數的測定 8.3電解質溶液的電導 電導、電導率、摩爾電導率 電導的測定 電導率、摩...
影響導電性的主要因素有電離度、電導、離子淌度、離子遷移數、離子活度和離子強度。電解質溶液電離度 達到電離平衡時,已電離的電解質分子數與其總分子數之比,以...
電化學是研究化學現象與電現象之間的相互關係以及化學能與電能相互轉化規律的學科。電化學沉積是指在外電場作用下電流通過電解質溶液中正負離子的遷移並在電極上發生...
遷移過程中的Gibbs自由能變化為:為液接電勢,對於上述電池,z=1。若遷移數不隨濃度變化,t++t-=1,有:可見液接電池是由於正、負離子遷移數的差別而引起的,t+...
實驗10 氯離子選擇性電極的測試和套用實驗11 希托夫法測定離子遷移數習題第7章 化學動力學實驗12 蔗糖轉化反應速率常數的測定實驗13 乙酸乙酯皂化反應速率常數的...
1.4.2 離子淌度1.4.3 離子遷移數1.5 電解質溶液的活度與活度係數1.5.1 複習有關活度的基本概念1.5.2 離子活度和電解質活度1.5.3 離子強度定律思考題...
七、測定化合物203八、求算離子遷移數203九、求算熱力學函式204第三節金屬的電化學保護措施206一、金屬的表面電化學鈍化206二、電化學緩蝕劑207三、陰極保護208...
阿累尼烏斯的電離學說的主要論點是,電解質溶解以後立即進行離解,不管是否有電流通過,溶液中永遠有離子存在。在這論點不僅使希托夫的電解溶液導電時的離子遷移數和...
在兩種溶液之間插入鹽橋以代替原來的兩種溶液的直接接觸,減免和穩定液接電位(當組成或活度不同的兩種電解質接觸時,在溶液接界處由於正負離子擴散通過界面的離子遷移...
Bannister等用高價陰離子的雙鹽[LiOOC(OF2)3OOLi]與聚醚攙雜,得到的配合物呈現較高的陽離子遷移數。而Stevens的研究也表明,單離子導體比雙離子導體的電導率變化...
Determination of transference numbers of NaBr in mixtures of H2O-EtOH at 298.15K by EMFNaBr在乙醇-水體系中298.15K下的離子遷移數 浙江大學學報33<1>, 19...
