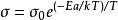簡介,理論詮釋,概念說明,分類,電解質水溶液,熔融電解質,固體電解質,套用,固態離子選擇電極,固體電化學器件,全固體電池和電色顯示器的電解質,快離子導體的發展趨勢,
簡介
導體依靠導體中離子的定向運動(也稱定向遷移)而導電,電流通過導體時,導體本身發生化學變化,導電能力隨溫度升高而增大。顧名思義,這類導體稱為離子導體(或稱為第二類導體)。電解質溶液、熔融電解質等屬於此類。
電子導體能夠獨立地完成導電任務,而離子導體則不能。要想讓離子導體導電,必須有電子導體與之相連線。因此,在使離子導體導電時,不可避免地會出現兩類導體相串聯的界面。即為了使電流能通過這類導體,往往將電子導體作為電極浸入離子導體中。當電流通過這類導體時,在電極與溶液的界面上發生化學反應,與此同時,在電解質溶液中正、負離子分別向兩極移動。
理論詮釋
在離子導體中,離子參與導電與
固體中的
點缺陷密切相關。純淨固體中的點缺陷是本徵缺陷,有
弗侖克爾缺陷和
肖特基缺陷兩類(見
點缺陷),前者是空位和填隙原子,後者為單純的空位。它們的
濃度決定於固體的
平衡溫度以及缺陷的生成能。含有雜質的固體還多出非本徵點缺陷,如KCl
晶體含有少量CaCl
2時,Ca
2+是二價離子,為了保持固體電中性,必須存在一個正離子空位(它帶一個負電荷),這種空位便是非本徵點缺陷。
在外加
電場作用下,離子固體中本徵的和非本徵的點缺陷都會對
離子電導作貢獻。離子電導率
σ與
溫度T的關係,遵從阿倫尼烏斯定律:
式中
σ0為
常數,
Ea為電導微活能,
k為玻耳茲曼常數。
固體中可動離子是陽離子的稱為陽離子導體,若是陰離子的則稱為陰離子導體。
概念說明
多數離子導體中可運動的
離子是很少的,因而離子電導率都不高。例如,
食鹽(NaCl),室溫下離子電導率僅有10
-15Ω
-1·cm
-1。
固體中除了本徵缺陷外,還有由於異價雜質的存在而產生的非本徵缺陷。例如,在
氟化鈣(CaF
2)中,如果有三價
金屬雜質離子存在,就必定會形成相等數量的間隙氟離子,以實現
電中性。這些本徵的和非本徵的點陣缺陷在外電場作用下都會進行長程運動,從而對離子
電導率作出貢獻。
快離子導體也是一種離子導體,但具有不同於一般離子導體的特徵。
分類
離子導體是依靠離子定向移動來導電的導體,包括電解質水溶液、有機電解質溶液、熔融鹽和固體電解質,其中最常見的是電解質水溶液。
電解質水溶液
從電離程度來看,過去曾把電解質分為強電解質和弱電解質兩類。這種分類不能解釋同一物質在不同溶劑中表現為弱電解質或強電解質的行為,因而不能作為物質屬性的分類法。現代觀點主張把電解質分為非締合式和締合式兩種。前者在水中形成陽離子和陰離子,沒有未離解的分子,也沒有形成離子對。鹵化鹼、鹼土鹵化物、過氯酸鹽和過渡金屬鹵化物等屬於這一類;後者在溶液中存在共價鍵形成的未離解的分子。全部的酸,包括鹵酸和過氯酸,它們通過靜電吸引而使陽離子、陰離子形成離子對。
溶劑化對電解質的性質有很重要的作用。作為溶劑的水,其結構對電解質的性質影響很大。分析水分子結構得知,兩個氫原子以104.5°夾角排在氧原子的兩邊。液體水在短程範圍內和短時間內具有和冰相似的結構。這個四面體是通過氫鍵形成的。液體狀態的水一般是網狀結構,水分子通過靜電作用聚集在一起,而熱運動又不斷破壞其聚集態,因此處在動態平衡之中,但也有一些游離的水分子。水是偶極分子,其正、負電荷中心不重合。因此,水分子受離子靜電的作用而定向在離子周圍形成水化殼,這是水的第一種溶劑化作用——離子水化。水分子還可使純態時不導電的電解質變成可導電的,這是第二種溶劑化作用;在酸鹼理論中,叫質子轉移或酸鹼反應。
水化離子對電解質溶液的性質產生兩種重要的影響。①減少溶液中自由分子的數量,增加離子的體積,起到均化作用,使離子的擴散係數接近相同。離子水化也改變了電解質的活度係數和電導等性質。②破壞了附近水層的四面體結構。由於水分子的偶極對離子的定向,而使離子鄰近水分子的介電常數發生變化。這種情況嚴重影響雙電層的結構,對電極過程和金屬電沉積都有不可忽視的影響。
水溶液中除了水化作用外,也存在締合作用。締合在電鍍上可以起到良好的輔助作用,例如無氰鍍銀時,加入的絡合劑就是起締合作用的。含咪唑銀絡離子的鍍銀液的穩定性和電鍍性能欠佳,但加入磺基水楊酸能改變該絡離子溶解的pH範圍,增加鍍液的穩定性,改進鍍層的性能。磺基水楊酸是咪唑銀絡離子的締合劑,由於它的強親水性,與咪唑銀絡離子締合後,形成一個強親水性的負離子,使本來在高pH值下水解的咪唑銀絡離子保持水溶狀態。
熔融電解質
熔融電解質一般指熔融狀態的鹽類,即熔鹽。常溫下鹽類是晶體,鹽熔化後,其結構仍然和晶體有類似之處。熔鹽中粒子間的平均距離與固態鹽中粒子間的平均距離相近,鹽熔化時各質點間的結合力只受到不大的削弱,熔鹽中粒子的熱運動仍然保持著固態粒子熱運動的性質。
雖然熔鹽結構仍未弄清,但是一般認為它是完全離解的離子液體。至少對於鹼金屬鹵化物是如此。因熔鹽的電離度大,且溫度高,使離子運動速率增大,故電導率常比其水溶液大得多。熔鹽發展已不限於無機鹽熔體,還包括氧化物熔體及熔融有機物。
固體電解質
固體電解質是一種離子導體。某些離子晶體能導電,但是電導率很小。20世紀60年代中期發現了快離子導體後,固體電解質才得到較廣泛的套用。可用固體電解質製作微型電池、燃料電池、定時器、記憶元件和檢測器探頭等。
當下已知的固體電解質有數百種,一般按照傳導離子的類型來分類。傳導離子大都是質量較輕,體積較小的離子,例如Ag+、Cu2+、Li+、O2-、F-等。銀離子導體有AgX、Ag2S、RbAg4I5等,銅離子導體有CuI、Cu2Hgl4和Cu2Se。鹼金屬離子導體主要是鋰離子導體和鈉離子導體。大多數氧離子導體以第四族副族的金屬或四價稀有金屬的氧化物(為主,摻雜一些價數較低金屬的氧化物才有實用價值,如測定氧的分壓。
套用
離子導體主要有以下幾方面的套用:
固態離子選擇電極
氧離子選擇電極(氧敏感測器)可用作測量金屬熔體中的含氧量、氣體中的含氧量以及檢測與氧有關的其他物質的濕度、真空度等。鈉離子選擇電極可測定合金中的鈉含量。銀離子選擇電極可測定AgNO3中的銀離子濃度。鹵素離子選擇電極可測氯、溴、碘的濃度。
固體電化學器件
可作庫侖計測量電量,還可用作微電路的積分元件、定時器、電開關等。可做可變電阻器、電化學開關、電積分器、雙電層電容器等。
此外,利用Na+、Li+離子導體內某些離子的氧化一還原著色效應可製作對比度大、大面積顯示和記憶的電色顯示器。還可作電池隔膜材料。
全固體電池和電色顯示器的電解質
可用作高比能全固態蓄電池的電解質,光電化學電池的電解質和全固體電色顯示器的電解質。
快離子導體的發展趨勢
1.研究更高的離子電導率的快離子導體特別是室溫高電導率的快離子導體,其中研究納米快離子導體是一個新的途徑,目標是使室溫電導率達到102~103S/cm。
2.研究新型的高分子離子導體,當下的高分子一鹽類的電導率很難超過10-4S/cm(25℃),要設計具有隧道結構、層狀結構或高結晶度的高分子,並選擇電荷分散型的陰離子(如帶芳香環)以便獲得寬而淺的勢阱,使其的導電機制類似於無機離子導體。
3.研究高分子單離子導體,這是指僅有單一陽(或陰)離子迅速傳導而無對離子遷移的高分子離子導體。我國研製的高分子鋰離子導體的電導率已達到10-6S/cm,這對於不要陰離子遷移的鋰電池,是一個重要的材料。