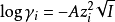
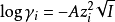

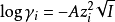
(休克爾)於1923年提出了強電解質溶液的理論:強電解質在低濃度溶強電解質在低濃度溶液中完全解離,並認為強電解質與理想溶液的偏差主要是由離子之間的靜電引力所...
德拜-休克爾極限公式的導出是建立在德拜和休克爾提出的強電解質離子互吸理論(也叫非締合式電解質理論)基礎上的。該理論公式假定強電解質完全電離,並認為庫侖力是...
十二、離子水化數參考文獻第四章 非締合式電解質的離子互吸理論一、引言二、離子霧及其電位三、離子霧的厚度四、電解質的活度係數...
直到1923德國化學家德拜(Debye)和休克爾(Hückel)提出的離子互吸理論才將其合理化。但較濃的溶液中離子相隔較近,所引起的完全反乎電離的行為不斷增大,至今電解質...
2.提出了"德拜比熱式",奠定了電解質偶極理論。3.1916年與謝勒合作,提出了用X射線粉末照相測定晶體結構的方法。4.提出了強電解質溶液的離子互吸理論,即德拜-...
4.提出了強電解質溶液的離子互吸理論,即德拜-休克爾理論。還建立了德拜-休克爾-翁薩格電導理論。5.提出了分子偶極矩概念及其測定方法,偶極矩單位就用德拜的...
1923年,P.J.W.德拜和E.休克耳考慮離子間的相互作用,建立了電解質溶液的定量理論,叫做德拜-休克耳理論(也叫離子互吸理論),又經L.昂薩格、H.法爾肯哈根等人...
5.1 電解質溶液理論 5.1.1 阿倫尼烏斯電離理論 5.1.2 德拜一休克爾離子互吸理論 5.2 酸鹼電離平衡 5.2.1 水的電離和溶液的酸鹼度 5.2.2 弱酸、弱鹼...
6.1.2離子互吸理論6.1.3活度和活度因子6.1.4離子強度-6.2酸鹼理論簡介6.2.1酸鹼質子理論6.2.2酸鹼電子理論6.2.3軟硬酸鹼理論...
它以豐富的化學現象和體系為對象,大量採納物理學的理論成就與實驗技術,探索、...8.5強電解質溶液理論簡介 Debye—Huckel離子互吸理論 Debye—Huckel—Onsager電導理論...
本書是一本綜合性物理化學實用手冊,涵蓋了物理化學的基礎理論知識、實驗操作技術...4.2.5強電解質溶液的離子互吸理論99 4.2.6德拜 休克爾極限定律99 4.2.7德拜...
7.5.2 強電解質溶液的離子互吸理論7.6 可逆電池與韋斯頓標準電池7.6.1 原電池及其表示7.6:2 可逆電池的條件7,6.3 韋斯頓標準電池7.7 原電池熱力學...
8.5.3強電解質溶液的離子互吸理論280 8.5.4德拜 休克爾 昂薩格電導理論282 習題283 第9章電化學286 9.1原電池和電動勢286 9.1.1幾種電勢286 9.1.2原電池的...
8.5.3強電解質溶液的離子互吸理論3178.5.4德拜 休克爾 昂薩格電導理論319思考題320習題321第9章電化學基礎3239.1原電池和電極電勢323...
7.3.4離子獨立移動定律857.4強電解質溶液理論867.4.1強電解質溶液的平均活度和離子強度867.4.2德拜-休克爾離子互吸理論887.5可逆電池89...
