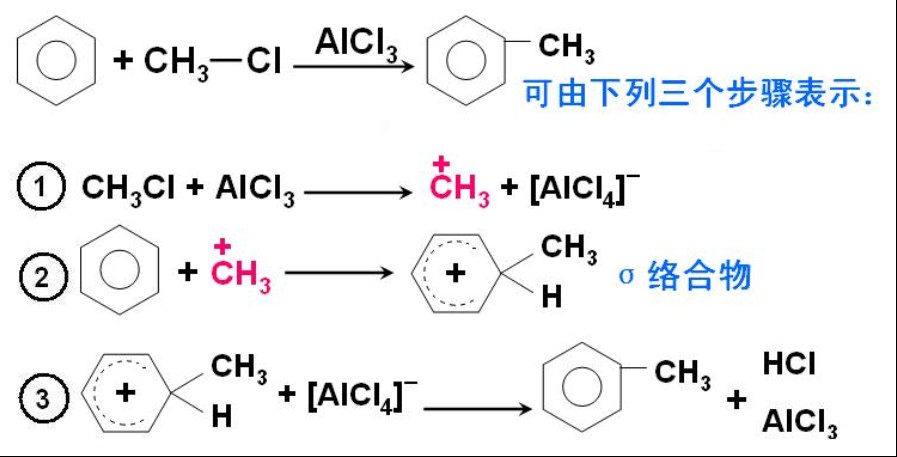
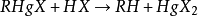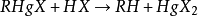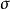定義
親電取代反應也可分為兩種機制,即單分子親電取代SE1和雙分子親電取代SE2,這與脂肪親核取代反應可分為SN1和SN2是類似的。
背景知識
有機反應類型分類
根據共價鍵斷裂的方式,有機化學反應可以分為協同反應,自由基反應,離子型反應。
協同反應:在反應過程中,舊鍵的斷裂和新鍵的形成都相互協調地在同一步驟中完成的反應稱為協同反應。協同反應往往有一個環狀過渡態。它事一種基元反應。
自由基型反應: 由於分子經過均裂產生自由基而引發的反應稱為自由基型反應。自由基型反應分鏈引發、鏈轉移和鏈終止三個階段。
離子型反應:出分子經過異裂生成離子而引發的反應稱為離子型反應 。 離子型反應有親核反應和親電反應。 由親核試劑進攻而發生的反應稱為親核反應,親核試劑是對正原子核有顯著親和力而起反應的試劑。由親電試劑進攻而發生的反應稱為親電反應。而親核以及親電反應又可以進一步分為加成反應和取代反應。
親電取代反應
凡由親電試劑如HNO3、H2SO4、Cl2、Br2等與有機分子相互作用而發生的取代反應,稱為親電取代反應(SE): E++RX-→RE+X+
式中R為烷基。上述類型的正離子取代反應屬於SE1類型反應。
親電取代反應是一種親電試劑取代其它官能團的化學反應,這種被取代的基團通常是氫,但其他基團被取代的情形也是存在的。親電取代是芳香族化合物的特性之一。芳香烴的親電取代是一種向芳香環系,如苯環上引入官能團的重要方法。其它另一種主要的親電取代反應是脂肪族的親電取代。
脂肪族的親電取代 :在脂肪族化合物的親電反應中,親電試劑進攻並取代反應物的一個官能團。該反應與更為常見的脂肪族親核取代反應類似,只不過進攻基團是親電試劑而非親核試劑。脂肪親電取代反應也可分為兩種機制,即SE1和SE2,這與脂肪親核取代反應可分為SN1和SN2是類似的。 典型的脂肪族親電取代反應包括: 酮上α-氫的鹵代反應,卡賓對碳-氫鍵的插入反應。
親電取代機理
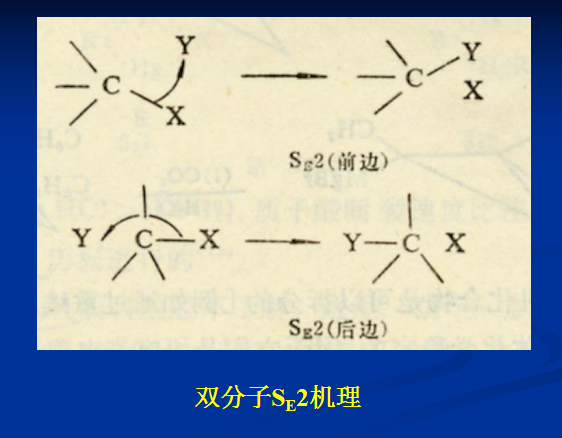
SE2機理:親電試劑從離去基團的背面進攻中心碳原子,首先生成較弱的鍵,同時離去基團與碳之間的鍵有一定程度的減弱,碳原子上的另外三個鍵也逐漸發生變化,由傘形到平面形,這需要消耗能量(活化能)。隨著反應的進行,當達到能量最高狀態即過渡態後,新鍵生成,舊鍵斷裂,碳原子上的其餘三個鍵由平面形重新變為傘形。整個過程象雨傘在大風中翻轉一樣。當反應物生成過渡態時,需要吸收活化能,過渡態為勢能的最高點,一旦形成過渡態,即釋放能量,形成產物。由於控制反應速率的一步是雙分子,需要兩種分子相互碰撞反應,故反應為雙分子的親電取代,表現為二級反應。
SEi機理:
這兩種機理是很難區分的。它們都表現為二級動力學,其中兩個機理SE2(前邊)和SEi保持構型不變,立體化學研究可以區分它們與SE2(後邊)反應。許多報導都表明這種二級親電取代反應中的絕大多數都保持構型不變,或者反映其他從前邊襲擊的跡象,因而這些反應是按SE2(前邊)或SEi機理進行的。
親電取代立體化學
SE2反應的立體化學:
從SE2反應機理可以看出,親電試劑從離去基團的背面進攻,其結果發生了構型的轉化。Ingold等人將光活性的2-碘辛烷與放射同位素碘離子在丙酮中進行交換反應,結果發現,消旋化速率是交換反應速率的兩倍,說明產物的構型發生了轉化——瓦爾登(Walden)轉化。反應物2—碘辛烷是S構型,經SE2反應後,構型完全轉化,成為R構型,旋光方向相反,R、S構型形成一對外消旋體,旋光抵消,因此,消旋化速率是交換反應速率的兩倍。
立體化學的證據支持了SE2機理,從構型的完全轉化,說明了親電試劑是從離去基團的背面進攻中心碳原子。絕大多數親電取代反應屬於SE2機理,大量的實驗事實證明了這一點。因此,SE2反應總是伴隨著構型的翻轉,或者說,完全的構型轉化往往是SE2反應標誌。 為什麼親電試劑總是從離去基團的背面進攻?這是由於①從正面進攻會受到攜帶電子的離去基團的排斥;②從背面進攻能形成較為穩定的過渡態,降低反應的活化能。
雙分子親電取代反應舉例
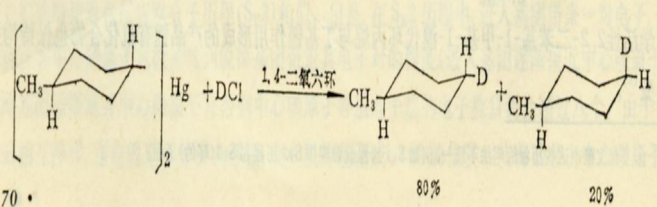
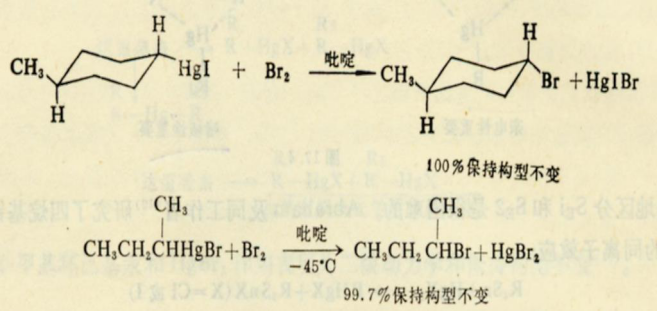
1)與HX反應
反應為二級動力學和產品的構型不變,表明反應是按SE2或SEi機理進行的。由於離解度比較小的酸(例如HCl>H
2SO
4),質子酸斷裂速度比較大,反應是按SEi機理進行的。事實上親電試劑襲擊的是碳原子和汞原子之間的
-鍵(亦即成鍵電子,而不是碳原子)。且碳原子可能帶有部分正電荷。
(2)與二烷基汞反應
可能的機理為:
同時鹽效應實驗表明對反應的影響是比較明顯的。如果中性反應物在過渡狀態中得到電荷,別提高加入的離子的濃度將有助於反應的進行,因而鹽效應對SEi機理的影響沒有對任何一種SE2機理的影響大,Abraham等提出這個反應是按SE2機理進行的,而不是按SEi機理進行的。
(3)與溴反應
與單分子親電取代差異性比較
SE1機理:SE1反應是分步進行的,反應物首先離解成碳負離子和帶正電荷的離去基團,反應需要能量(活化能),形成C-中間體,這是控制反應速率的一步。當分子解離後,C-立即與親電試劑結合,生成產物,此步反應極快。C—X鍵的離解需要較高能量,當達到能量最高點時,形成第一個過渡態Ts1[R3C…..X],然後快速解離成C-中間體, C-與Nu+成鍵也需要一定的能量,經過[R3C….Nu]過渡態Ts2形成產物。由於決定反應速率的一步是過渡態勢能最高的一步,即C—X鍵的離解,此步只涉及到一種分子,因此,反應稱單分子親核取代反應。
與SE1反應相對應,SE2反應中,親電試劑進攻具親核性的富電子
中心原子,形成
過渡態的同時,
離去基團離去。反應中不生成
碳正離子,
速率控制步驟是上述的協同步驟,反應速率與兩種物質的濃度成正比,因此稱為雙分子親電取代反應。無機化學中,常稱雙分子親電取代反應類型的反應機理為“交換機理”。SE2反應一步完成。單分子親電取代反應分兩步進行,雙分子親電取代反應只有一步,他們都有構型翻轉或保持。
SE2屬於
二級反應,決速步與兩個反應物的濃度相關:親電試劑和底物。與此相對比的是單分子親電取代反應—SE1反應的
速率控制步驟只和底物的濃度有關,稱為單分子親電取代反應。
需要注意的是,SE1和SE2隻是親電取代反應的兩個比較極端的機理,屬於理想情況。在因素如
離子對的影響下,實際中的反應都會或多或少地兼具這兩者機理的成分,有些甚至難以歸類。
至於反應按哪種機理進行的成分多一些,與具體的反應物結構、類型、溶劑、濃度、溫度、親電試劑、
離去基團等因素都有很密切的關係。