基本介紹
- 中文名:二級反應
- 外文名:second order reaction
- 方程式:dx/dt=k(a-x)(b-x)
- 特點:與兩個反應物濃度的乘積成正比
- 分類:化學
- 舉例:甲醛的熱分解等
簡介,原理,分類,
簡介
二級反應是指反應速度與兩個反應物濃度的乘積成正比,也就是與反應物濃度的二次方成正比的化學反應。二級反應的反應速度方程式為:dx/dt=k(a-x)(b-x),a與b分別為反應物開始時的濃度,x為生成物的濃度。
原理
二級反應的反應速度方程式為:dx/dt=k(a-x)(b-x),a與b分別為反應物開始時的濃度,x為生成物的濃度。二級反應的半衰期為1/(k*a) (只適用於只有一種反應物的二級反應;兩種反應物的二級反應的半衰期公式比較複雜,除包含速率常數k外,還與反應物起始濃度有關),即開始時反應物濃度愈大,則完成濃度減半所需的時間愈短。二級反應最為常見,如乙烯、丙烯、異丁烯的二聚反應,乙酸乙酯的水解,甲醛的熱分解等,都是二級反應。
對於速率方程的詳細推導過程如下,
1.對於

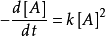
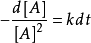
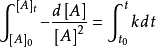
解得:
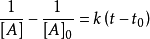
2.對於

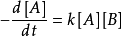
為簡化模型,設x為t 時間內反應新生成的產物的量,於是有
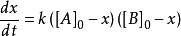
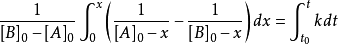
解得:
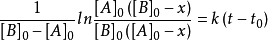
其中,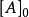 為物質A的起始濃度,[A]為反應 t 時間後的實際濃度;
為物質A的起始濃度,[A]為反應 t 時間後的實際濃度;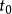 為反應起始時間。如果用a代表
為反應起始時間。如果用a代表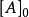 ,用b代表
,用b代表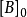 ,x仍為新生成的產物,且起始時間為0,則1和2的公式可分別表示為
,x仍為新生成的產物,且起始時間為0,則1和2的公式可分別表示為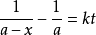 與
與 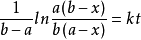 。
。
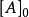
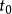
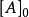
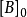
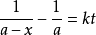
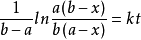
如需求反應半衰期,只需令x為起始濃度的一半,根據速率方程解出時間即可,此處不再詳細推導公式。
分類
反應速率與物質濃度的二次方成正比(即級數比n=2)的反應。對反應aA+bB→P,速率方程分兩種情況:
(1)r=kC2A,稱為純二級反應,1/CA~t圖為一直線,其半壽期與初始濃度成反比(t1/2=1/C0Ak)。如碘化氫氣相熱分解2HI→I2+H2即屬此類;