過渡族金屬能與H、B、C、N等原子半徑甚小的非金屬元素形成化合物,它們具有金屬的性質,很高的熔點和極高的硬度。當非金屬X和金屬M的原子半徑比值rx/rm<0.59時,化合物具有比較簡單的晶體結構,稱為間隙相。而rx/rm>0.59時,其結構很複雜。通常稱為間隙化合物。
基本介紹
- 中文名:間隙相
- 外文名:interstitial phase
- 含義:形成結構較簡單化合物
- 特徵:原子半徑比小於0.59
基本介紹
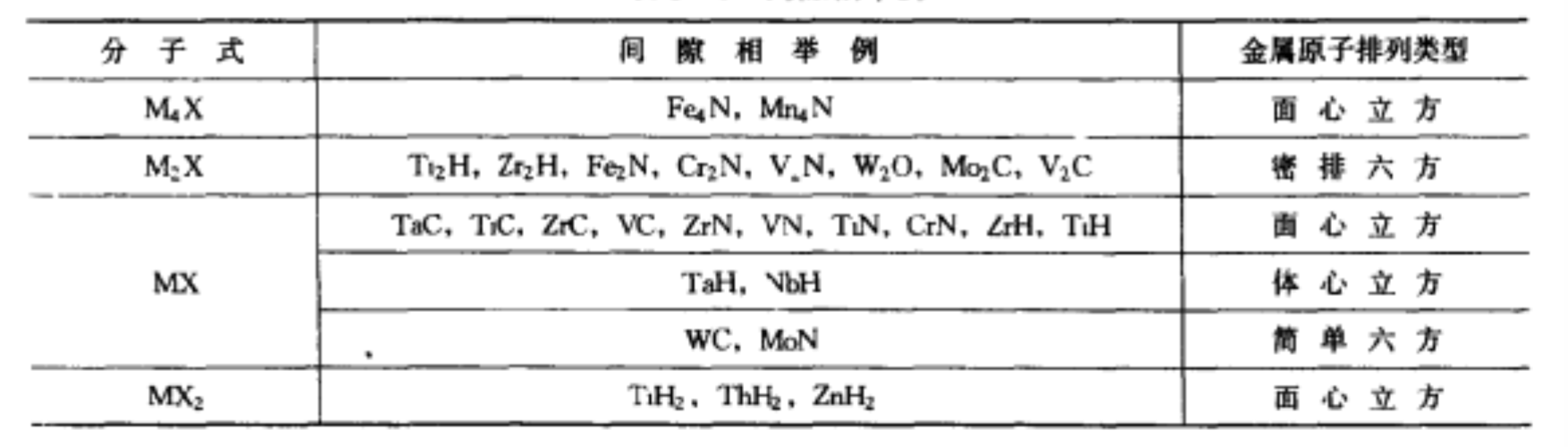 間隙相舉例
間隙相舉例分類
熔點
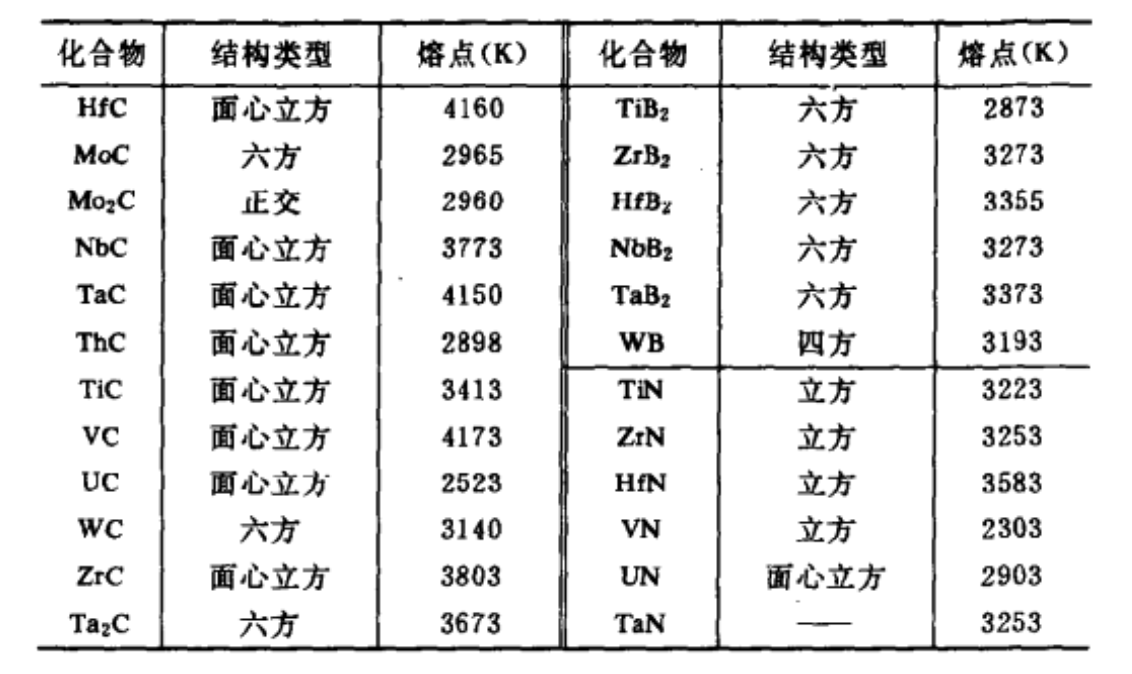 某些碳化物、氮化物和硼化物的結構和熔點
某些碳化物、氮化物和硼化物的結構和熔點過渡族金屬能與H、B、C、N等原子半徑甚小的非金屬元素形成化合物,它們具有金屬的性質,很高的熔點和極高的硬度。當非金屬X和金屬M的原子半徑比值rx/rm<0.59時,化合物具有比較簡單的晶體結構,稱為間隙相。而rx/rm>0.59時,其結構很複雜。通常稱為間隙化合物。
 間隙相舉例
間隙相舉例 某些碳化物、氮化物和硼化物的結構和熔點
某些碳化物、氮化物和硼化物的結構和熔點當非金屬X和金屬M的原子半徑比值rx/rm<0.59時,化合物具有比較簡單的晶體結構,稱為間隙相。而rx/rm>0.59時,其結構很複雜。通常稱為間隙化合物。[1] ...
間隙化合物指由過渡族金屬元素與碳、氮、氫、硼等原子半徑較小的非金屬元素形成的金屬化合物。根據組成元素原子半徑比值及結構特徵的不同,可將間隙化合物分為間隙...
間隙溶液,作為理想的金屬晶格而言,氫、氧、氮、碳(硫除外,它不屬於間隙相元素),在達到一定濃度值以前,將僅以間隙溶液形式存在。...
在八面體型間隙相中,6個金屬原子構成八面體,間隙原子位於八面體中心的間隙位置,具有這種間隙類型的間隙相可以是面心立方、密排六方、正交和體心立方等點陣的...
頜下間隙感染是指頜下間隙急性化膿性感染,主要臨床表現有頜下區豐滿,淋巴結腫大、壓痛。頜下間隙形成膿腫時範圍較廣,膿腔較大,如為淋巴結炎引起的蜂窩組織炎,...
舌下間隙(subblingual space)呈馬蹄鐵型,位於下頜體的內側,上界為口底黏膜,下界為下頜舌骨肌及舌骨舌肌,前外側為下頜舌骨線以上的下頜骨體內側面骨壁,後界止於...
在八面體型格隙相中,6個金屬原子構成八面體,格隙原子位於八面體中心的間隙位置,具有這種格隙類型的間隙相可以是面心立方、密排六方、正交和體心立方等點陣的...
會陰淺間隙 superficial perineal space: 與陰囊肉膜下間隙和陰莖淺筋膜下間隙及腹前外側壁下部淺筋膜下間隙相續。 間隙內3對肌肉:即會陰淺橫肌、球海綿體肌和...
晶界大尺寸間隙相,特別是大尺寸二維薄片狀間隙相能促進晶間裂紋的形成。類似於上述分析,斷裂過程中。在不同的晶界滑移情況下,晶間裂紋的形成如圖。 [3] ...
