間隙化合物指由過渡族金屬元素與碳、氮、氫、硼等原子半徑較小的非金屬元素形成的金屬化合物。
根據組成元素原子半徑比值及結構特徵的不同,可將間隙化合物分為間隙相和具有複雜結構的間隙化合物。 當非金屬與金屬的原子半徑比是小於0.59時,形成具有單晶格的間隙化合物,稱為間隙相。當比值大於0.59時,形成具有複雜結構的間隙化合物。
基本介紹
- 中文名:間隙化合物
- 外文名:Interstitial compound
- 含義:過渡金屬元素與非金屬元素化合物
- 套用:材料科學
分類






結構

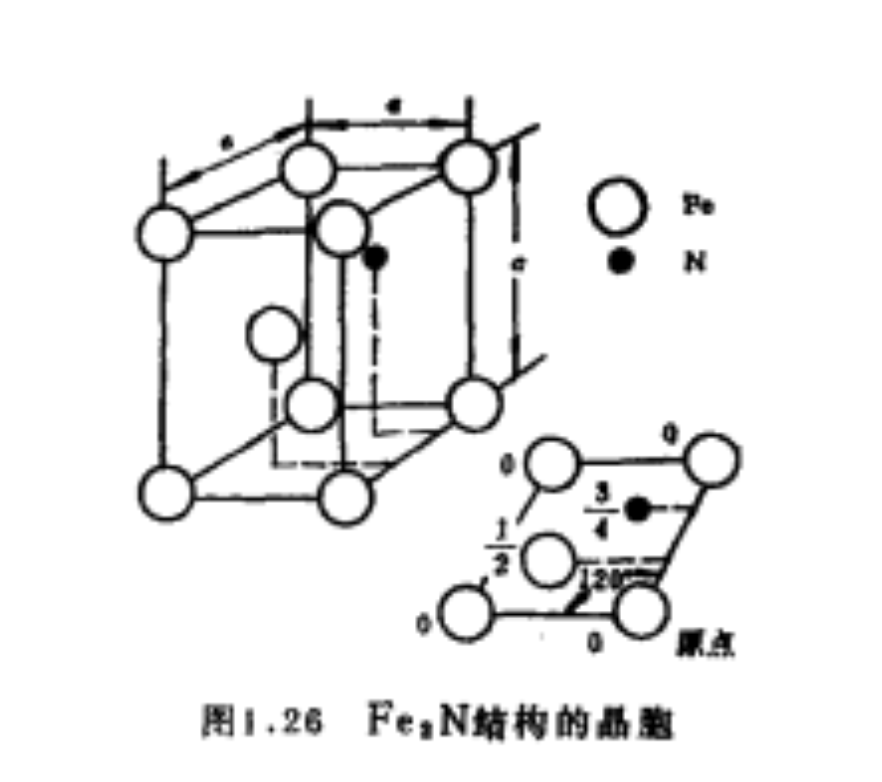 Fe2N結構晶胞
Fe2N結構晶胞
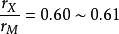

間隙化合物指由過渡族金屬元素與碳、氮、氫、硼等原子半徑較小的非金屬元素形成的金屬化合物。
根據組成元素原子半徑比值及結構特徵的不同,可將間隙化合物分為間隙相和具有複雜結構的間隙化合物。 當非金屬與金屬的原子半徑比是小於0.59時,形成具有單晶格的間隙化合物,稱為間隙相。當比值大於0.59時,形成具有複雜結構的間隙化合物。







 Fe2N結構晶胞
Fe2N結構晶胞
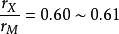

間隙化合物指由過渡族金屬元素與碳、氮、氫、硼等原子半徑較小的非金屬元素形成的金屬化合物。根據組成元素原子半徑比值及結構特徵的不同,可將間隙化合物分為間隙...
固溶體又有間隙式和置換式、有限和連續、無序和有序之分。中間相又分為正常價化合物、電子化合物和尺寸因素化合物等,其結構和性能存在很大的不同。 [1] ...
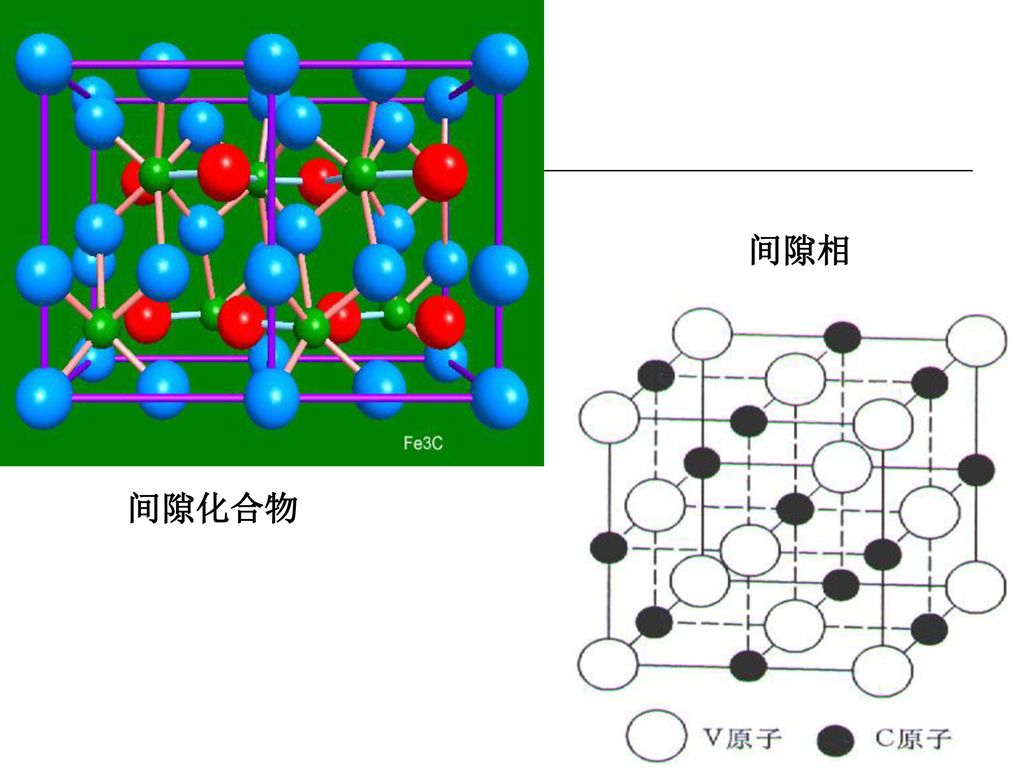
滲碳體(cementite)是鐵與碳形成的金屬化合物,其化學式為Fe3C。滲碳體的含碳量為ωc=6.67%,熔點為1227℃。其晶格為複雜的正交晶格,硬度很高HBW=800,塑性、韌性...
按照結合鍵的類型,中間相可以分為離子化合物、共價化合物和金屬化合物;按照它們的形成規律和結構、性能特徵,又可區分為正常價化合物、電子化合物、 間隙化合物和...
氮化物是氮與電負性比它小的元素形成的二元化合物。由過渡元素和氮直接化合生成的氮化物又稱金屬型氮化物。它們屬於 “間充化合物”,因氮原子占據著金屬晶格中的...
碳化鐵是高溫下形成的間隙化合物,碳—鐵之間有很強的結合力,性能堅硬而脆。若生鐵中的碳,主要以碳化鐵形式存在,這種生鐵的斷面呈銀白色。叫白口鐵,通常用做煉鋼...
2.15間隙化合物2.15.1間隙化合物的分類: H?gg規則2.15.2間隙化合物的結構2.15.3間隙化合物的特性2.16合金相結構符號習題第3章晶體的範性形變...
這些新材料都是在二十年代所建立的間隙化合物晶體結構的基礎上發展出來的。 [3] X射線金相學電子化合物 編輯 Westgren及Phragmén在從事碳化物晶體結構研究的同時,...
氮化鈦膜是指由鈦氮化合物組成的薄膜。氮化鈦屬於間隙化合物,具有美麗的金黃色光澤,化學穩定性好,熔點高達3000℃,維氏顯微硬度為20GPa左右。...
間隙化合物由一種金屬元素(如過渡元素)與氫、硼、碳、氮、矽可形成具有金屬性質的化合物。當rx/rm≤0.59時(rx與rm分別為非金屬與金屬原子半徑),則金屬原子...
1994年至今在中科院物理所從事新型智慧型材料探索,新型稀土過渡族金屬化合物及其間隙化合物的基本磁性研究,高有序金屬間化合物磁性材料研究和磁性合金的單晶生長動力學...
對於尺寸因素化合物,其結枃主要取決於原子半徑之比ra/rA,其中A為過渡金屬,B為間隙元素(H、B、C、N)。rs/rA<0.59時構成簡單間隙化合物;r/rA≥0.59時,...
金屬矽化物是指過渡金屬與矽生成的硬質化合物。由於矽原子半徑較大,不能與過渡金屬生成間隙化合物,因而這類硬質化合物化學成分穩定金屬矽化物具有好的抗氧化性。....
四、金屬間隙化合物碳化鎢的1500 C高溫合成及其鑑定(高溫技術)五、金屬間化合物LaNi5的高頻感應加熱法合成及其產物的X射線粉末衍射法鑑定(高頻感應加熱技術、X射線...
Laves相就是一種化學式主要為AB2型的密排立方或六方結構的金屬間化合物。Laves相中原子半徑比rΑ/rB約在1.1~1.6之間。在許多Laves相(AB2)中,過渡族金屬一般...
研究生期間國際上首次製備了高Sn替代量的間隙化合物,通過實驗和能帶理論計算了替代原子的作用,得到較好的結果,在華師大主持完成一項上海市新材料中心有關納米微晶絲...
Fe3C中的鐵原子可以被其他金屬原子所置換,形成以間隙化合物為基體的固溶體,一般把它們稱為合金滲碳體。當合金元素很少時,合金元素將不能自己形成特有的碳化物,只能...
二次固溶體,又稱第二類固溶體,是以化合物為基的固溶體,具有金屬性。固溶體是指礦物一定結晶構造位置上離子的互相置換,不改變整個晶體的結構及對稱性等。但是微觀...
溶解度時,多餘的碳可以以鐵的碳化物形式或以單質狀態(石墨)存在於合金中,可形成一系列碳化物,其中Fe3C(滲碳體,6.69%C)是亞穩相,它是具有複雜結構的間隙化合物。...
(inter-mediate phases).中間相包括正常價化合物、電子化合物、laves相、σ相、間隙相和複雜結構的間隙式化合物等等.合金在平衡狀態下可能出現的相可以從相平衡圖...
這個學派的Hagg 還研究了過度族金屬的氮化物、硼化物、氫化物的晶體結構,在1930 年總結出間隙化合物晶體結構的規律。如果間隙原子的半徑Rx 與過渡族金屬的半徑RM ...
9.2Sm2Fe17Nx間隙化合物稀土永磁材料 9.2.1R2Fe17Nx間隙化合物的形成 9.2.2R2Fe17Nx間隙化合物的結構 9.2.3R2Fe17Nx間隙化合物的內稟磁特性 9.2.4Sm2Fe17Nx...
金屬化合物是金屬鍵與離子鍵或共價鍵相混合作用的,因此具有一定的金屬特性。典型的金屬化合物分為三類:正常價化合物、電子化合物和間隙化合物。...
根據溶質原子在晶格中所占位置可將固溶體分為置換固溶體和間隙固溶體。置換固溶...金屬化合物當合金中溶質的含量超過了固溶體的固溶度時,除了形成固溶體外,還可以...
