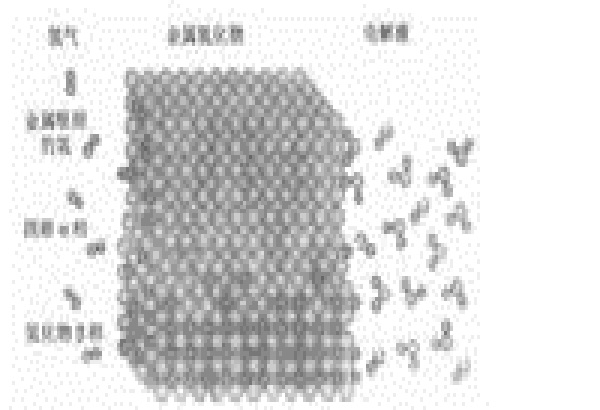
間隙溶液,作為理想的金屬晶格而言,氫、氧、氮、碳(硫除外,它不屬於間隙相元素),在達到一定濃度值以前,將僅以間隙溶液形式存在。
基本介紹
- 中文名:間隙溶液
- 外文名:Interstitial solution
- 屬性:冶金術語
- 相關:金屬晶格
- 分類:溶液
定義,濃度大小,相關研究,
定義
半徑分別接近於0.46、0.7、0.71、0.77的氫、氧、氮、碳的原子填充到金屬晶格的結點中間並不置換金屬原子,使晶格對稱性稍有扭曲。除間隙固溶體外,氣體在金屬中還能以剩餘相(凝聚相和氣態相)形式,圍繞位錯堆聚的形式以及在內表面上的吸著形式存在。
氣體雜質元素的原子在間隙固溶體和位錯附近的堆聚區之間可以達到平衡分配,在溫度急劇改變的情況下,原先接近平衡的氣體-金屬系統變成不平衡,為吸著和解吸過程的發展提供條件。
濃度大小
室溫下通常此相濃度界限不大,且隨著溫度的升高而增大。在給定的溫度下,超過溶解度時則形成次級固溶體(氫化物、氮化物或氧化物相)。次級固溶體的晶體結構與初級的不同。例如:400攝氏度時,氮在鐵中形成一種填隙式固溶體,濃度可達0.4個氮原子/100個鐵原子。
此時氮含量在初級固溶體範圍,未超過極限溶解度,該相呈體心立方晶形存在,這正是在相應溫度下,溶劑金屬鐵的結構。當加入更多的氮,超過極限溶解度則形成次級相,Fe4N(r,);它含有24.1-25.8個氮原子/100個鐵原子的氮。這種次級相是面心立方結構。當氮含量達到35.5個氮原子/100個鐵原子時,形成密堆積六角形相,因此可看出加入氣體會改變金屬原子的堆積形式。
相關研究
同時提出,通過比較由第一性原理的不同計算方法獲取的相關數據和詳細分析元素的微觀組成可為物質的晶格穩定性提供合理的解釋。