基本介紹
金化合物介紹,金的碘化物,
金化合物介紹
Au2O
不能由Au直接氧化製得,是將AuOH小心加熱至208℃脫水而得。Au2O為紫灰色粉末,不溶於水,易溶於HCl和王水,受熱分解成金;在NH3溶液中反應生成爆炸性金的氮化物Au3N·NH3。
此外還可以用以下反應製取:
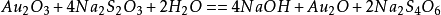
Au2O3
熱分解Au(OH)3而製得,為棕黑色粉末,不溶於水,溶於無機酸;也溶於KOH,是兩性化合物。在0℃Au2O3就已很容易為H2或CO還原為Au,與氨水反應生成易爆化合物雷金。
AuOH
將KOH加到AuCl溶液中,製得深紫色沉澱AuOH,不溶於水,溶於KOH,生成K[Au(OH)2]。
Au(OH)3
將苛性鹼溶液加入HAuCl4,沉出黃褐色Au(OH)3,實際上是水合金酸H[AuO2]·H2O,為兩性化合物。Au(OH)3溶於濃HNO3,稀釋溶液,又生成Au(OH)3沉澱,用此法可精製Au(OH)3。與氨水反應生成雷金,H2或CO在低溫即可將Au(OH)3還原為金。
Au2S和Au2S3
是將H2S通至K[Au(CN)。]溶液中沉澱出Au:S;通至AuCl。的無水乙醚溶液中沉澱出Au2S。前者為銅灰色粉末,後者為黑色粉末。在自然界存在的硫族化合物有碲金礦AuTe。。
AuCl
熱分解AuCl。而製得,為黃色不溶於水的固體,在室溫為-亞穩態化合物,會緩慢分解為Au和AuCl3。
AuCl3
將金氯化或在氯中加熱HAuCl4製得。為紅色晶體,易溶於水而生成H[AuCl3(OH)];在光照下還原為金屬。FeSO4、SO2、H2C2O4、N2H4·H2O、HCHO、H2等能使AuCl。從溶液中還原為金屬;鎂、鋁、鋅、鐵等能從AuCl。溶液中置換出金,甚至鉛、銅、銀、鈀等不活潑金屬也有此作用。氨水從AuCl溶液中沉澱出雷金。
AuCN
淡黃色晶體,略溶於水,HCN作用於Au(OH)3而製得。
Au(CN)3
白色晶體,溶於冷水,在熱水中慢慢分解,用H2SiF6作用於K[Au(CN)4]而製得。
金的絡合物Au(I)與配體CN、CS(NH2)2、S2O3、SO3、NH3、R3P和Au(Ⅲ)與配體Cl、CN、SO3、SCN、NH3、PY、R3P生成的絡合物最常見。氰化法提金就是基於NaCN或KCN與礦石中的細粒Au反應,生成可溶性絡合物Na[Au(CN)4]或K[Au(CN)4],達到金的分離和提取。在Fe抖存在下,硫脲的酸性溶液也與Au生成可溶性絡合物Au[CS(NH2)2]X,在濕法提金中有重要作用。Au溶於王水生成絡合物H[AuCl4],有NaCl或KCl存在時得到:Na[AuCl4]·2H2O或K[AuCl4]。氯金酸及其鹼金屬鹽在金的冶煉中起重要作用。
金的碘化物
金的碘化物受到重視,用碘化法可使金提純至99.999%。

