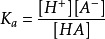古典的酸鹼理論,酸鹼電離理論,定義,衡量標度,弱酸與強酸,進步性,局限性,酸鹼溶劑理論,定義,與電離理論的聯繫,溶劑的分類,拉平溶劑與區分溶劑,進步性,局限性,酸鹼質子理論,定義,酸鹼共軛,酸鹼反應,進步性,局限性,酸鹼電子理論,定義,酸鹼反應類型,與質子理論的比較,地位,有機反應機理,進步性,局限性,軟硬酸鹼理論,定義,酸鹼軟硬度,反應規律,進步性,局限性,注意事項,聯繫,不常見的理論,Usanovich的定義,Lux-Flood的定義,
古典的酸鹼理論 人類對於酸鹼的認識經歷了漫長的時間。最初人們將有酸味的物質叫做酸,有澀味的物質叫做鹼。17世紀英國化學家
波義耳 將植物汁液提取出作為指示劑,對酸鹼有了初步的認識。在大量實驗的總結下,波義耳提出了最初的酸鹼理論:凡物質的水溶液能溶解某些金屬,與鹼接觸會失去原有特性,而且能使石蕊試液變紅的物質叫酸;凡物質的水溶液有苦澀味,能腐蝕皮膚,與酸接觸會失去原有特性,而且能使石蕊試液變藍的物質叫鹼。這種定義比以往的要科學許多,但仍有漏洞,比如一些酸和鹼反應後的產物仍帶有酸或鹼的性質。此後,拉瓦錫、戴維,李比希等科學家對此觀點進一步進行補充,逐漸觸及酸鹼的本質,但仍然沒有能給出一個完善的理論。
酸鹼電離理論 定義 瑞典科學家
阿倫尼烏斯 (Arrhenius)總結大量事實,於1887年提出了關於酸鹼的本質觀點——酸鹼電離理論(Arrhenius酸鹼理論)。在酸鹼電離理論中,酸鹼的定義是:凡在水溶液中電離出的陽離子全部都是H
+ 的物質叫酸;電離出的陰離子全部都是OH
- 的物質叫鹼,酸鹼反應的本質是H
+ 與OH
- 結合生成水的反應。(這裡的氫離子在水中的呈現形態是
水合氫離子 (H
3 O
+ ) ,但為書寫方便,在不引起混淆的情況下可簡寫為H
+ )
衡量標度 在酸鹼電離理論中,水溶液的酸鹼性是通過溶液中氫離子濃度和氫氧根離子濃度衡量的:氫離子濃度越大,酸性越強;氫氧根離子濃度越大,鹼性越強。同時,298K下,稀溶液中始終存在
,所以氫離子或氫氧根離子中一者濃度增加時,另一者濃度必然下降,酸和鹼是對立的。
為方便書寫,定義
,則
pH 越小,溶液的酸性越強;
pH 越大,溶液的鹼性越強。
弱酸與強酸 酸鹼電離理論指出,各種酸鹼的
電離度 不一定相同,有的達到90%以上,有的只有1%,於是就有
強酸 和
弱酸 、
強鹼 和
弱鹼 之分,強酸和強鹼在水溶液中完全電離,弱酸和弱鹼則部分電離。一元強酸(鹼)溶液中氫離子(氫氧根離子)濃度等於強酸自身的濃度,弱酸(鹼)溶液中氫離子(氫氧根離子)濃度小於弱酸的濃度。
酸中存在電離平衡,設酸的通式為HA,則
平衡常數 ,
,強酸的
Ka >1,
pKa <0,反之為弱酸。
進步性 酸鹼電離理論更深刻地揭示了酸鹼反應的實質;
由於水溶液中H+ 和OH- 的濃度是可以測量的,所以這一理論第一次從定量的角度來描寫酸鹼的性質和它們在化學反應中的行為,酸鹼電離理論適用於pH 計算、電離度計算、緩衝溶液計算、溶解度計算等,而且計算的精確度相對較高,所以至今仍然是一個非常實用的理論。
阿倫尼烏斯還指出,
多元酸 和多元鹼在
水溶液 中分步離解,能電離出多個氫離子的酸是多元酸,能電離出多個氫氧根離子的鹼是多元鹼,它們在電離時都是分幾步進行的。
局限性 在沒有水存在時,也能發生酸鹼反應,例如
氯化氫 氣體和
氨氣 發生反應生成
氯化銨 ,但這些物質都未電離,電離理論不能討論這類反應。
將氯化銨溶於
液氨 中,溶液即具有酸的特性,能與金屬發生反應產生氫氣,能使指示劑變色,但氯化銨在液氨這種
非水溶劑 中並未電離出H
+ ,電離理論對此無法解釋。
碳酸鈉在
水溶液 中並不電離出OH
- ,但它卻顯鹼性,電離理論認為這是碳酸根離子在水中發生了
水解 所至。
在解釋NH3 水溶液的鹼性的成因時,人們一度錯誤地認為,是先生成了NH4 OH,而後電離出OH- 。
要解決這些問題,必須使酸鹼概念脫離溶劑(包括水和其他
非水溶劑 )而獨立存在。同時,酸鹼概念不能脫離化學反應而孤立存在,酸和鹼是相互依存的,而且都具有相對性。
酸鹼溶劑理論 定義 富蘭克林 (Franklin)於1905年提出酸鹼溶劑理論,其內容是:凡是在溶劑中產生該溶劑的特徵陽離子的溶質叫酸,產生該溶劑的特徵陰離子的溶質叫鹼。
例如:液氨中存在如下平衡:
因此在液氨中電離出NH4 + 的是酸,例如NH4 Cl,電離出NH2 - 的是鹼,例如NaNH2。
液態N2 O4 中存在如下平衡:
因此在液態N2 O4 中電離出NO+ 的是酸,例如NOCl,電離出NO3 - 的是鹼,例如AgNO3。
酸鹼溶劑理論中,酸和鹼並不是絕對的,在一種溶劑中的酸,在另一種溶劑中可能是一種鹼。
與電離理論的聯繫 酸鹼溶劑理論可以看做是酸鹼電離理論在非水溶劑中的拓展——酸鹼電離理論中由水自偶電離產生的H+ 與OH- ,在酸鹼溶劑理論中則變為溶劑自偶電離出的陰陽離子,酸鹼溶劑理論進一步發展了酸鹼電離理論,並且對後來的理論有一定影響。
溶劑的分類 按照溶劑的自偶電離情況,可將溶劑分為兩類:
質子型溶劑:自偶電離過程中有質子參與的溶劑,如氟化氫,水,液氨等;
非質子型溶劑:自偶電離過程中無質子參與的溶劑,如四氧化二氮,三氧化硫等。
按照溶劑的酸鹼性,可以將溶劑分為:
兩性的中性溶劑:既可以作為酸,又可以作為鹼的溶劑。當溶質是較強的酸時,這種溶劑呈鹼性;當溶劑是較強的鹼時,這種溶劑呈酸性。常見的例子有水和醇;
酸性溶劑:這種溶劑也是兩性溶劑,但酸性比水大。常見的例子有乙酸,硫酸等;
鹼性溶劑:這種溶劑也是兩性溶劑,但鹼性比水大。常見的例子有液氨,乙二胺等。
拉平溶劑與區分溶劑 在酸鹼電離理論中,強酸的酸性強度是無法區分的,因為它們在水中的電離都相當徹底,無法分辨哪種酸更強。但是大量實驗事實表明,強酸的強度依然是有區別的,例如,在乙酸作為溶劑時,可測得高氯酸,硫酸與硝酸的酸性大小是HCLO4 >H2 SO4 >HNO3 ,這種某種溶劑能夠區分酸或鹼強度的效應稱為區分效應 ,對應的溶劑稱為被區分酸的區分溶劑 。相應的,像在水這種鹼性相對較強的溶劑中,強酸的酸性是由水合氫離子體現的,水的鹼性消除了強酸的酸性差別,這種將不同強度的酸拉平到溶劑化質子水平的效應,稱為拉平效應 ,對應的溶劑稱為被拉平酸的拉平溶劑 。
進步性 擴大了酸鹼的範圍,在不同的溶劑中,有對應的不同的酸和鹼;
能很好地說明以下反應:
局限性 不能說明形如CaO + SO3 = CaSO4 的不在溶劑中進行的反應;
不能說明在苯、氯仿、醚等不電離溶劑體系中的酸鹼反應。
酸鹼質子理論 定義 布朗斯特(J.N.Bronsted)和勞里(Lowry)於1923年提出了酸鹼質子理論(Bronsted酸鹼理論),對應的酸鹼定義是:”凡是能夠給出
質子 (H
+ )的物質都是酸;凡是能夠接受質子的物質都是鹼。”由此看出,酸鹼的範圍不再局限於電中性的分子或離子化合物,帶電的離子也可稱為“酸”或“鹼”。若某物質既能給出質子,也能接受質子,那么它既是酸,又是鹼,通常被稱為”酸鹼兩性物質“。為了區別出酸鹼質子理論,有時會將該理論中的”酸“稱作”質子酸“,該理論中的”鹼“稱為”質子鹼“。
酸鹼共軛 酸(HA)和鹼(A- )之間存在以下關係:
上式中的酸鹼稱為共軛酸鹼對 ,鹼是酸的共軛鹼,酸是鹼的共軛酸,這個式子表明,酸和鹼是相互依賴的。
同時,易證得:在水溶液中,
,因此,共軛酸的酸性越強,共軛鹼的鹼性越弱,反之,共軛酸的酸性越弱,共軛鹼的鹼性越強。
酸鹼反應 在以下反應中:
HCl和H
3 O
+ 都能夠釋放出
質子 ,它們都是酸;H
2 O和Cl
- 都能夠接受質子,它們都是鹼:
酸1 + 鹼2 → 酸2 + 鹼1
酸
1 和鹼
1 、酸
2 和鹼
2 是兩對
共軛酸鹼對 。上式說明,當一種分子或離子失去質子起著酸的作用的同時,一定有另一種分子或離子接受質子起著鹼的作用,單獨的一對共軛酸鹼無法發生酸鹼反應。形如“酸 = 鹼 + H
+ ”的反應不可發生,稱為
酸鹼半反應 。
為了簡化書寫,在不引起混淆時,可以把質子傳遞反應中的H3 O+ 簡寫為H+ ,得到一個類似於酸鹼半反應的反應式,例如:
這個反應式實際上是對氯化氫與水的反應的簡寫,並不是酸鹼半反應,雖然它和酸鹼半反應看起來是一模一樣的。具體需要區分簡寫式與半反應式時,聯繫上下文不難分析出。
由通式也可以看出,一種物質是酸還是鹼,是由它在酸鹼反應中的作用而定。HCO
3 - 與NaOH反應時放出
質子 ,此時它是一種酸,HCO
3 - 與HCl反應時,它又接受質子,則是一種鹼。又例如,硝酸在水中是一種酸,而溶解在純硫酸中時卻是一種鹼。由此可見,酸和鹼的概念具有相對性。
進步性 擴大了酸的範圍。只要能夠釋放出
質子 的物質,不論是否在水溶液中,不論是離子還是電中性分子,它們都是酸,例如NH
4 + 、HCO
3 - 、HSO
4 - 、HS
- 、HPO
4 2- 、H
2 O。
擴大了鹼的範圍。NH3 、Na2 CO3、 F- 、Cl- 、Br- 、I- 、HSO4 - 、SO4 2- 等物質都能接受質子,都是鹼。
擴大了酸鹼反應的範圍。在酸鹼電離理論中,酸與鹼反應的產物必然是“鹽”和水,然而在酸鹼質子理論中則沒有此要求。酸鹼電離理論中的中和,強酸置換弱酸,酸鹼的電離,鹽類的水解,氨氣與氯化氫氣體的反應等,都是酸鹼反應。
提出了酸鹼的相對性。
局限性 酸鹼質子理論仍有解釋不了的反應,例如有下列反應:
在這個反應中SO3 顯然具有酸的性質,但它並未釋放質子;CaO顯然具有鹼的性質,但它並未接受質子。
又如實驗證明了許多不含氫的化合物(它們不能釋放質子) 如AlCl3 、BCl3 、SnCl4 都可以與鹼發生反應,但酸鹼質子理論不認為它們是酸。
再如,液態N2 O4 存在如下平衡:
有如下反應:
這個反應非常類似於酸鹼反應,但因為無質子轉移,酸鹼質子理論無法處理。因此,酸鹼理論需要進一步的改進。
酸鹼電子理論 定義 1923年美國化學家
吉爾伯特·牛頓·路易斯 (Gilbert Newton Lewis)指出 ,沒有任何理由認為酸必須限定在含氫的化合物上,他的這種認識來源於氧化反應不一定非有氧參加。路易斯是
共價鍵理論 的創建者,他用結構的觀點,提出了酸鹼電子理論(Lewis酸鹼理論):酸是電子的接受體,鹼是電子的給予體。酸鹼反應是酸從鹼接受一對電子,形成配位鍵,得到一個酸鹼加合物的過程,該理論體系下的酸鹼反應被稱為
酸鹼加合反應 。其通式為:
通常,酸鹼電子理論中的”酸“被稱為Lewis酸,”鹼“被稱為Lewis鹼,以示區別。
酸鹼反應類型 酸鹼電子理論中,有四種基本反應類型:
酸鹼加合反應:酸和鹼反應生成酸鹼加合物的反應;
酸取代反應:由一種強酸從另一種由弱酸形成的酸鹼加合物中置換出弱酸的反應;
鹼取代反應:由一種強鹼從另一種由弱鹼形成的酸鹼加合物中置換出弱鹼的反應;
雙取代反應:兩種酸鹼加合物互相交換成分,形成兩種更穩定的酸鹼加合物的反應。
與質子理論的比較 Lewis鹼包括全部Brownst鹼,Lewis酸則不一定包括Brownst酸。例如,在質子酸鹼理論中,HCl是一種質子酸,然而在Lewis酸鹼理論中,HCl是Lewis酸——H+ 與Lewis鹼——Cl- 結合而成的酸鹼加合物。
地位 路易斯酸鹼反應是化學中三大基本反應類型之一(另兩者為氧化還原反應與自由基反應)。
有機反應機理 路易斯酸鹼理論認為許多有機反應也是酸鹼反應,例如CH
3 + 、C
2 H
5 + 、CH
3 CO
+ 都是酸,分別與鹼H
- 、OH
- 、C2H5O
- 結合成加合物CH
4 、C
2 H
5 OH、CH
3 COOC
2 H
5 。在有機反應中,Lewis酸是
親電試劑 ,Lewis鹼是
親核試劑 。
進步性 進一步擴大了酸與鹼的範圍,能說明不含
質子 的物質的酸鹼性,包括金屬陽離子、
缺電子化合物 、極性雙鍵分子(例如
羰基 分子)、價層可擴展原子化合物(某些P區元素的配合物)、具有孤對電子的中性分子、含有C=C鍵分子(例如
蔡斯鹽 ),套用最為廣泛;
擴大了酸鹼反應的範圍,更深刻地指出了酸鹼反應的實質。
局限性 無法準確描述酸鹼的強弱程度,難以判斷酸鹼反應的方向與限度。
軟硬酸鹼理論 定義 在前人工作的基礎上,拉爾夫·皮爾遜(Ralph G. Pearson)於1963年提出軟硬酸鹼理論(HSAB):體積小,正電荷數高,
可極化性 低的
中心原子 稱作硬酸,體積大,正電荷數低,可極化性高的中心原子稱作軟酸。將電負性高,極化性低難被氧化的
配位原子 稱為
硬鹼 ,反之為
軟鹼 ; 除此之外的酸鹼為交界酸鹼。
酸鹼軟硬度 1983年,
皮爾遜 與羅伯特·帕爾共同提出了計算酸鹼軟硬度的方法,計算得到的軟硬度稱作
化學硬度 。
反應規律 皮爾孫提出的酸鹼反應規律為:“硬酸優先與
硬鹼 結合,軟酸優先與
軟鹼 結合。”這雖然是一條經驗規律,但實驗證明以下規律與HSAB理論完全吻合:
取代反應都傾向於形成硬-硬、軟-軟的化合物。
軟-軟、硬-硬化合物較為穩定,軟-硬化合物不夠穩定。
硬溶劑優先溶解硬溶質,軟溶劑優先溶解軟溶質,許多有機化合物不易溶於水 ,就是因為水是
硬鹼 。
解釋反應機理:有機反應中的傅克烷基化反應以無水氯化鋁(AlCl3 )做催化劑,其機理就是AlCl3 是硬酸,與RCl中的硬鹼Cl- 結合而活化。
進步性 適用於討論金屬離子的配合物體系;
準確預言Lewis酸鹼反應方向;
預言配合物穩定性;
局限性 適用範圍不能包括整個Lewis酸鹼體系;
僅是一條定性的規律,不能定量計算反應的程度(K );
注意事項 酸鹼的軟硬程度與酸鹼強度是不同的概念,處理酸鹼反應時需要綜合考慮反應物的酸鹼性與軟硬程度。在酸鹼的軟硬度與酸鹼性相當時,酸鹼的軟硬度對反應的方向起主導作用。
聯繫 歷史上酸鹼理論各有特點,但它們並非是完全不相干的,下面的維恩圖展現了當前最常使用的四種酸鹼理論之間的關係(HSAB看做電子理論的補充,不在圖內標出):
酸鹼理論間的聯繫 從圖中可以看出,酸鹼電子理論的範圍是最廣的。事實上,幾乎現存其他所有理論概念均被包含其中,所有酸鹼反應均可用酸鹼電子理論(結合HSAB)處理,但需要定量計算時,電子理論則無能為力。
酸鹼質子理論在處理有質子傳遞的酸鹼反應時優勢較大,因為相較於電離理論,質子理論的適用範圍更寬;相較於電子理論,質子理論的定量計算更完備。
酸鹼溶劑理論可以用於處理非質子溶劑中的酸鹼反應,同樣可以做一些定量計算,但由於其限制條件較大,實用性相對較小,一般很少使用。
酸鹼電離理論則以其易於理解性占有優勢。在稀的水溶液中,用電離理論得出的計算結果與用質子理論完全相同,而且在處理部分計算問題上,它比質子理論簡潔些許,因此在定量計算上的套用仍然較廣。
所以在處理酸鹼問題時,要合理選擇酸鹼理論,才能得出正確結論,並達到最佳化處理過程,節約時間的目的。
另外,在綜合上述理論之後不難發現,在上述酸鹼理論中,大部分酸鹼反應都不是氧化還原反應,因為在這些理論中酸鹼反應總是伴隨著離子鍵的斷裂或共價鍵的
異裂 ,基本不存在電子的得失或電子對的轉移。
不常見的理論 Usanovich的定義 這一酸鹼定義來自於俄羅斯化學家Mikhail Usanovich。根據該定義,只要是可以接受負電荷或放出
正電荷 ,就是酸,反之則是鹼。因為這個定義與氧化還原的定義有些重合,所以化學家並不是很傾向於使用這個定義。這是因為氧化還原主要集中討論物理上的電子轉移過程,而並非是鍵的形成與斷裂過程,儘管要將兩者完全區分是不可能的。
Lux-Flood的定義 這個定義由德國化學家Hermann Lux在1939年時所提出,其後H.kon Flood約在1947年作進一步的修正,主要用於現代熔鹽的地球化學和電化學研究中。根據此理論定義:能接受氧離子O2- 的物質是酸,能提供氧離子的物質是鹼。
酸 = 鹼 + O2-
缺點:適用面較小。




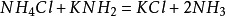

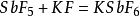



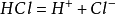


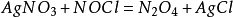
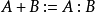
 酸鹼理論間的聯繫
酸鹼理論間的聯繫