基本介紹
簡介
方程形式



氣體種類 | a [kPa 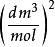 | b [  |
氦氣(He) | 3.45 | 0.024 |
氫氣(H2) | 24.32 | 0.027 |
氮氣(N2) | 141.86 | 0.039 |
氧氣(O2) | 137.80 | 0.032 |
二氧化碳(CO2) | 364.77 | 0.043 |
水蒸氣(H2O) | 557.29 | 0.031 |

范德瓦耳斯方程一般指本詞條



氣體種類 | a [kPa 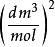 | b [  |
氦氣(He) | 3.45 | 0.024 |
氫氣(H2) | 24.32 | 0.027 |
氮氣(N2) | 141.86 | 0.039 |
氧氣(O2) | 137.80 | 0.032 |
二氧化碳(CO2) | 364.77 | 0.043 |
水蒸氣(H2O) | 557.29 | 0.031 |
范德華方程是荷蘭物理學家范德瓦耳斯(van der Waals,又譯“范德華”、“凡德瓦耳”)於1873年提出的一種實際氣體狀態方程。范德華方程是對理想氣體狀態方程的一...
范德瓦爾斯狀態方程是荷蘭物理學家范德瓦爾斯於1873年提出的一種實際氣體狀態方程。是對理想氣體狀態方程的一種改進,特點在於將被理想氣體模型所忽略的的氣體分子自身...
范德瓦耳斯常數是范德瓦爾斯狀態方程中的兩個常數,常用字母a和b表示,其值可由實驗測定的數據確定。范德瓦爾斯狀態方程是荷蘭物理學家范德瓦爾斯於1873年提出的一種...
約翰尼斯·迪德里克·范·德·瓦耳斯(通常稱為范德·瓦耳斯或范德華,Johannes Diderik van der Waals,1837年-1923年),荷蘭物理學家。曾任阿姆斯特丹大學教授。對...
三次型方程能展開成為摩爾體積的三次式的半經驗方程。這類方程比較簡單,僅含兩個或三個方程參數。常用的有:狀態方程范德瓦耳斯方程 J.D.范德瓦耳斯於1873年對...
范德瓦耳斯假設氣體分子是有相互吸引力的剛球,作用力範圍的半徑大於分子的半徑,氣體分子在容器內部與在容器壁處受到的力不同。范德瓦耳斯方程能較好地給出高壓強下...
雷德利希-鄺氏狀態方程(Redlich-Kwong equation of state),簡稱R-K方程,是物理化學中基於范德瓦耳斯方程的一個近似描述真實氣體行為的狀態方程。此方程是由猶太裔...
在物理和熱力學中,狀態方程描述的是態函式之間的關係。更具體地,狀態方程是描述...物態方程實際氣體 范德瓦耳斯(Van der Waals)方程昂尼斯(Onnes)方程...
范德瓦耳斯方程(van der Waals equation),簡稱范氏方程,是荷蘭物理學家范德瓦耳斯於1873年提出的一種實際氣體狀態方程。范氏方程是對理想氣體狀態方程的一種改進,...
范德華方程(van der Waals equation)(一譯范德瓦耳斯方程),簡稱范氏方程,是荷蘭物理學家范德華於1873年提出的一種實際氣體狀態方程。范氏方程是對理想氣體狀態...
對應狀態原理是物理化學中的概念,最早由約翰內斯·范德瓦耳斯在1873年提出,內容是:對於不同的氣體,如果有兩個對比參數(壓力、體積、溫度)相同,則第三個對比參數...
▪ 塑流 ▪ 屈服 ▪ 土動力學 ▪ 骨幹曲線 ▪ 波動方程 ▪ 機械阻抗 ▪ 導納 ▪ 顆粒分析試驗 ▪ 顆粒級配 ▪ 粒徑分布曲線 ▪ 不均...
兩個特徵參數的狀態方程(如范德瓦耳斯方程、RK方程、PR方程等),轉化為不含特徵參數的普遍化狀態方程,也可將壓縮因子和對比溫度、對比壓力的關係繪製成普遍化壓縮...
分子間的相互作用使分子能在低溫時成為凝聚態,這也是范德瓦耳斯方程中a的來源,所以也統稱為分子間的范德瓦耳斯力。由於分子間存在相互作用,使得氣體在壓力較高時偏...
選讀之七克拉貝隆及理想氣體狀態方程116選讀之八比熱容、潛熱與布萊克116選讀之九氣體的液化與低溫的獲得安德魯斯與臨界點118選讀之十范德瓦耳斯方程的建立119...
在化學和物理研究中,平均場理論在不同的層次上被多次“發明”:范德瓦耳斯的狀態方程是最早的平均場理論,後來還有很多不同的名稱。1937年朗道提出了二類相變的普遍...
隨後,荷蘭物理學家約翰內斯·范德瓦耳斯提出了范德瓦耳斯方程,為後來較高溫度下的測量結果預測系統臨界行為提供理論基礎。1898年,詹姆斯·杜瓦實現了氫氣的液化。十年...
2.4 道爾頓分壓定律和混合氣體的狀態方程2.5 范德瓦耳斯狀態方程思考題習題第3章 氣體分子熱運動速度及其能量的統計分布律3.1 機率的基礎知識...
范德瓦耳斯方程18 三相點25 水的特殊性29 第三章 千奇百怪的相變現象34 廣延量和強度量34 鐵磁和反鐵磁相變36 合金的有序-無序相變44 變化多端的中間相...
范德瓦耳斯方程 熱傳遞 傳導 對流 輻射 熱的交換和保溫 物態變化 熔解和凝固 汽化 氣體的液化 升華和凝華 熱機 永動機 電與磁的科學史 靜電 電荷之間的作用力 ...
9.12實際氣體等溫線326*9.13范德瓦耳斯方程327*9.14非平衡態輸運過程331提要335思考題337習題339科學家介紹玻耳茲曼342今日物理趣聞E大爆炸和宇宙膨脹345...
1880年,范德瓦耳斯又提出了“對應態定律”,進一步得到物態方程的普遍形式。在他的理論指導下,英國人杜瓦(J. Dewar)於1898年實現了氫的液化。他所在的荷蘭萊頓...
有的氣態膜甚至需要用更複雜的二維空間的范德瓦耳斯公式表示:式中b和a0是兩個常數。應當指出,在范德瓦耳斯氣體狀態方程中體積的校正項為分子本身體積的四倍,但...
狀態方程在此用作聯繫弙i與T、p、x的模型。相平衡至少涉及兩個相,因之選用狀態方程時,要求方程能兼用於系統所包含的兩個相。早就知道范德瓦耳斯方程能兼用於汽...
