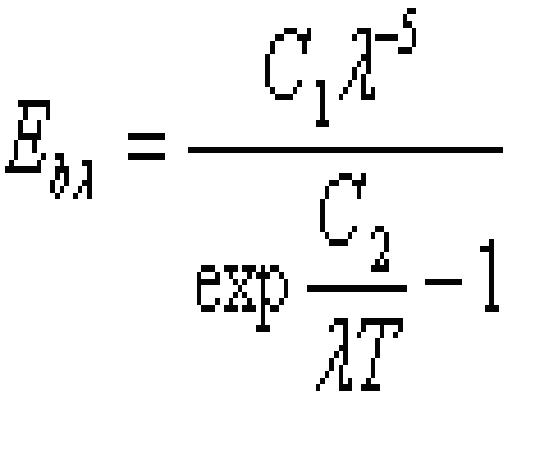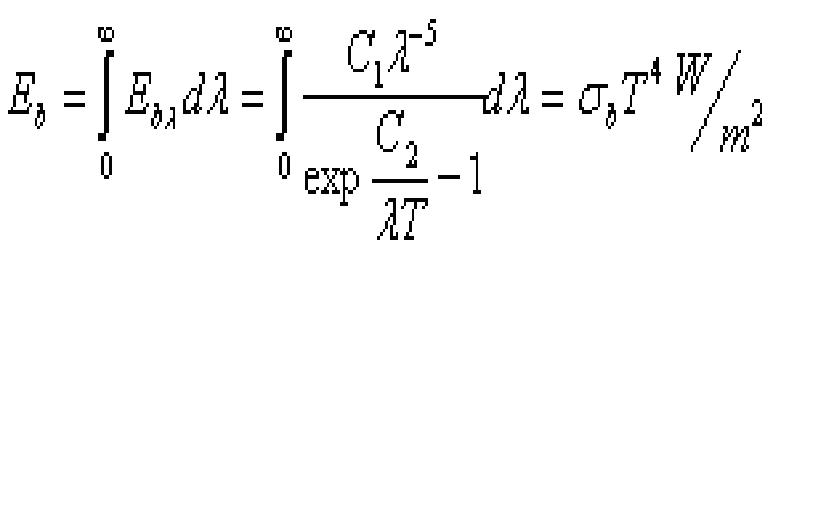相態轉換
一、三態六變及吸熱放熱情況
二、生物質氣化原理
三、沼氣的產生
四、氣體液化的原因
概敘
其實把這些能源縮小到微觀世界你不難發現,他們無非就是碳、氫、氧加上其它一些的元素組合而成。就像我們小時候玩的積木一樣,不同的組合有不同的結果(核能源除外)。在把他們放大到巨觀世界,他們的外在表現無非就是固態、液態和氣態三種,其他的表現形式都是以這三種相態為基礎發展而來的,比如混合體、等離子等。把固態、液態和氣態三種狀態在縮小到微觀世界,他們其實就是分子排列上的差異罷了。當然實現不同的排列會有不同的理化要求也會有不同的理化性質表現。這樣,從微觀到巨觀再到微觀,不同的能源之間的相互轉換就有了理論上的可操作性。能源的相態轉換其目的就是改變現在的能源領域的散、亂、雜互不相通的局面,實現能源之間的相互轉換,從而達到清潔、高效地利用能源,進而促成能源的良性循環。能源的相態轉換其作用在這裡僅舉幾個簡單的例子:比如說把煤炭的直接燃燒轉換成氣態燃燒或液態使用——從民生領域講,一年四季的生活用煤、冬季的洗浴用煤將發生什麼變化,環境呢?從工業領域講,假如把電煤都轉換成煤氣然後在發電會是什麼樣子?所涉及的行業會發生那些變化?;各類農林副產品的氣化——比如把18億畝耕地的農作物秸稈都轉換成優質燃氣將折合成多少標煤?農村的環境又是什麼樣子?;在進一步該優質燃氣如果達到或接近天然氣的標準進而實現他們之間的互換,我們現在生活的世界將是什麼樣子?氣態燃料的液化——燃料液化後從運輸的角度講,在民生領域將節約多少輸氣管網?液態燃料的氣化——把燃料油轉換成氣體燃料使用也許汽車尾氣就不是問題了。
部分基本定律
1.質量守恆定律:在化學反應中,參加反應前各物質的質量總和等於反應後生成各物質的質量總和。這個規律就叫做質量守恆定律
2.能量守恆定律:能量既不會憑空產生,也不會憑空消失,它只能從一種形式轉化為其他形式,或者從一個
物體轉移到另一個物體,在轉化或轉移的過程中,能量的總量不變
3.電荷守恆定律:電荷的總量既不能創造,也不能消失,只能從一個物體轉移到另一物體,或者從物體的一部分轉移到另一部分。這就是電荷守恆定律,也就是說:在與外界沒有電荷交換的一個系統內,總電荷量不變(電荷的
代數和不變)
4.熱力學定律
(1)熱力學第零定律:任一熱力學的均相體系,在平衡態各自都存在一個狀態函式,稱之為溫度(符合為T);它具有這樣的特徵,對於一切互呈熱平衡的均相系,其溫度彼此相等。
(2)熱力學第一定律:自然界一切物體都具有能量,能量有各種不同形式,它能從一種形式轉化為另一種形式,從一個物體傳遞給另一個物體,在轉化和傳遞過程中能量的總和不變。
(3)熱力學第二定律:不可能把熱從低溫物體傳到高溫物體而不產生其他影響;不可能從單一熱源取熱使之完全轉換為有用的功而不產生其他影響;不可逆熱力過程中熵的微增量總是大於零。
(4)熱力學第三定律:不可能用有限個手段和程式使一個物體冷卻到絕對溫度零度
(1)(1)玻意耳定律(玻—馬定律)
當n,T一定時 V,p成反比,即V∝(1/p)
(2)查理定律
當n,V一定時 p,T成正比,即p∝T
(3)蓋-呂薩克定律
當n,p一定時 V,T成正比,即V∝T
(4)阿伏伽德羅定律
當T,p一定時 V,n成正比,即V∝n
6. 伯努利定律:在一個流體系統中,比如氣流、水流中,流速越快,流體產生的壓力就越小 。
7.熱輻射定律:
(1).普朗克定理
揭示了黑體單色輻射力 和波長 ,熱力學溫度T之間的關係:
——波長;
T——熱力學溫度;
C1——普朗克第一常數;
C2——普朗克第二常數。
(2).史蒂芬—玻爾茲曼定理
Cb=5.67 ,
稱為黑體輻射係數。
(3).蘭貝特餘弦定理
黑體在任何方向上輻射強度與方向無關
對漫輻射表面,輻射力是任意方向輻射強度的 倍
(4)基爾霍夫定律
在給定溫度下,對於給定波長,所有物體的比輻射率與吸收率的比值相同,且等於該溫度和波長下理想黑體的比輻射率。
相態
相態是物質在一定溫度、
壓強下所處的相對穩定的狀態,是物質聚集狀態的簡稱,也稱聚集態。
氣態、
液態、
固態是
物質三態,相應的物質分別稱為氣體、液體、固體。它們是以
分子或
原子為基元的3種聚集狀態。水汽、水 、冰是常見的同一物質的三態;固態物質的分子或原子只能圍繞各自的
平衡位置微小振動,固體有一定的形狀、大小;液態物質的分子或原子沒有固定的平衡位置,但還不能分散遠離,液體有一定體積,形狀隨容器而定,易流動,不易壓縮;氣態物質的分子或原子作無規則熱運動,無
平衡位置,也不能維持在一定距離,氣體沒有固定的體積和形狀,自發地充滿容器,易流動,易壓縮。
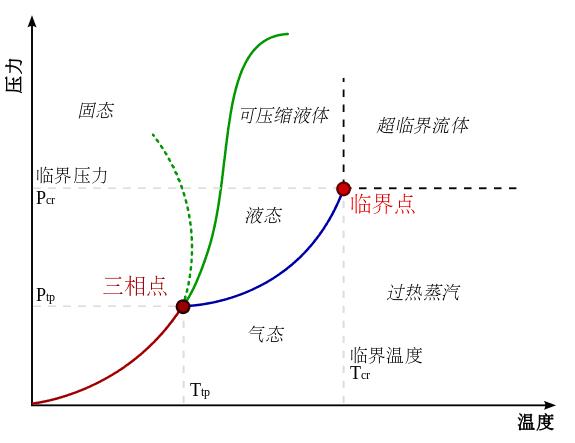
相圖,也稱相態圖、相平衡狀態圖,是用來表示
相平衡系統的組成與一些參數(如
溫度、
壓力)之間
關係的一種圖。以水為例其簡單的相圖如下:
相態轉換
一、三態六變及吸熱放熱情況
液化:(兩種方法:壓縮體積和降低溫度): 氣態→液態 (放熱)
(注意:這裡所說的“吸熱”與“放熱”的“熱”都是指的
熱量,而不是指的
溫度、
內能、
熱值、
比熱容等熱
力學概念。即為“吸收熱量”與“放出熱量”的簡稱。在物理學中,熱量不能說“含有多少熱量”或“具有多少熱量”,只能說“吸收了多少熱量”或“放出了多少熱量”)
二、生物質氣化原理
秸稈氣化包括熱解、燃燒和還原反應。在以空氣為介質的氣化器中,總的反應式可寫作:CH1.4O0.6 +0.4O2+(1.5N2) Õ 0.7CO+0.3CO2+0.6H2+0.1H2O+(1.5N2)
上式中CH1.4O0.6代表生物質的分子式,以空氣為氣化介質意味著同時加入氧氣和氮氣。因為氮氣不參加反應,反應後留在燃氣中沖淡了可燃成分,所以以空氣為介質的氣化只能得到低發熱值的燃氣,發熱值一般在5~6MJ/m3。
熱解反應
原料進入氣化器後,在熱量的作用下,首先被乾燥,當溫度升高到250℃時開始發生熱解反應。熱解是高分子有機物在高溫下吸熱所發生的不可逆裂解反應。其總的結果是大分子的碳氫化合物的鏈被打碎,析出生物質中的揮發物,留下木炭構成進一步反應的床層。高溫時,生物質的熱解產物是非常複雜的混合氣體,其中至少包括數百種碳氫化合物。有些可以在常溫下冷凝形成焦油,有些不冷凝氣體可以直接作為氣體燃料使用,是相當不錯的中熱值乾餾氣,發熱值可達15MJ/m3。熱解是一個十分複雜的過程,其真實的反應包括若干沿著不同路線的一次、二次乃至高次反應,不同的反應路線得到不同的產物。
總的來說,熱解反應是一個吸熱過程,但由於生物質原料中含較多的氧,當溫度升高到一定程度後,氧將參加反應而使溫度迅速提高,從而加速完成熱解。工藝條件如溫度和加熱速率等的不同,反應產物得率變化有變化,如緩慢裂解可以得到40~50%的木炭,這是典型的木炭生產工藝;而快速裂解(500K/s)可以將生物質的70%轉換成蒸汽,冷卻後得到裂解油-–一種目前國際上很關注的新能源產品。秸稈氣化工藝的目的是得到可燃氣體,不必過多考慮這些中間反應過程,但在熱解反應中產生的焦油影響燃氣使用,需要抑制其產生並從燃氣中去除。
加熱速率是影響熱分解結果的主要因素之一。按加熱速率快慢可分為慢速分解、快速熱分解及閃蒸熱分解等,溫度與加熱速率是相互關聯的,低溫熱分解相應是慢速熱分解,高溫熱分解通常伴的較快的加熱速率。
慢速熱分解
低溫(低於500oC),慢加速率(小於100C)及原料的長停留時間(可以分小時或天計)是慢速熱分解的主要標誌。焦油及炭為其主要產物。在理論研究上,慢慢熱分解有助於研究熱分解過程機理及了解熱分解的全過程。在實際應階段用上,慢速熱分解多發生在固定床反應器中。
閃蒸熱分解
閃蒸熱分解是在中等反應溫度(400~600oC)下,加熱速率達到10~1000 oC/s,揮發物的停留時間少於2s,主要產物為焦油(油)。
快速熱分解
非常高的加熱速率(1000~10000 oC/S),高反應溫度(600 oC以上),及揮發物很短的停留時間(少於0.5S)為快速熱分解的區別,其主要產物為高質量的氣體,很少焦油及炭形成,在很高的加熱速率下,甚至沒有一產次炭、氣體中含較多的烯烴與碳氫化合物,可作合成汽油或其他化工產品的原料,快速分解是氣化研究中渴望達到的目標,在氣化爐的設計中,力求加快熱解過程的速率,快速流化床在氣化技術中的套用,就是快速熱分解在氣化實踐中的具體體現。
氧化(燃燒)反應熱解反應和後面敘述的還原反應都是吸熱反應,為維持反應必須供應足夠的熱量,最簡單的方法是向反應層供入空氣,通過燃燒獲得熱量。參與燃燒的主要是碳和空氣。主要的反應有:
C+O2 = CO2
2C+O2 = 2CO
2CO+O2 = 2CO2
2H2+O2 = 2H2O
氧化層的反應主要是碳和空氣的兩相反應,其化學反應速度可以用所消耗的氧量表述為:
K = a(C¥ -Cn )
K = k Cn N
其中 K:單位面積單位時間碳表面消耗的氧量;
a:傳質係數;
C¥ :遠處的氧濃度,對氣化器就是空氣中的氧濃度;
Cn :碳表面的氧濃度;
k :化學反應常數。燃燒需要消耗大量的氧,而這些氧是從周圍空氣中擴散到碳表面的,碳表面氧消耗以後濃度降低,周圍的氧就在濃度差的作用下向碳表面移動,式5-9表述了空氣中的氧向碳表面的傳輸速度。
式5-10表述了碳與氧的化學反應速度。這兩個速度應該是相等的,合併兩式並消去Cn,得到:
因此,實際控制燃燒反應的是1/a表征的氧擴散阻力和1/ k表征的化學反應阻力。化學反應常數(k)隨著溫度升高而迅速增加。但傳質係數a 受溫度影響很小。
溫度較低時,化學反應速度(k)很小,當1/ k >>1/a,可以忽略擴散阻力的影響,燃燒速度由化學反應速度控制,稱作動力反應。在氣化器中,實際燃燒溫度超過1500K,這時化學反應速度即k值很大,1/ k <<1/a,可以忽略化學反應阻力的影響而認為燃燒速度完全由空氣中的氧向碳表面的擴散速度所控制,稱為擴散反應。
式5-11變為K≈aC 在擴散反應時,化學反應速度大大超過了氧的擴散速度,燃燒得十分劇烈,以至於空氣中的氧一達到碳的表面,立刻被消耗光,碳表面氣體中的氧含量幾乎等於零。因此氧化層的厚度很小,只有3~4個原料顆粒的當量直徑。增加通風強度,只會使燃燒更加劇烈,氧消耗得更快,而不會增加氧化層的厚度。
還原反應:還原層位於氧化層的後方,燃燒後的水蒸氣和二氧化碳與碳反應生成氫和一氧化碳等,從而完成了固體生物質原料向氣體燃料的轉變。
主要的反應有:
C+H2O = CO+H2 NiSO'
C+CO2 = 2CO
C+2H2 = CH4
還原反應是吸熱反應,溫度越高反應越強烈。溫度低於600℃時,反應已相當緩慢。因此還原層與氧化層的界面是氧含量等於零的界面,還原層結束的界面大致為溫度等於600℃的界面。還原層的反應受擴散和動力反應的共同控制,其高度應是反應機制和供熱機制平衡的結果。反應機制包括二氧化碳向碳粒表面的擴散,一氧化碳自表面的解析,炭表面的反應活性,溫度等因素。供熱機制包括氣固兩相的熱容量,氣相的流速,以及兩相間的傳熱和傳質等
三、沼氣的產生
沼氣的產生,簡單的說,是有機物質在隔絕空氣和保持一定水分、溫度、酸鹼度、碳氮比等條件下,經過多種微生物的分解而產生的。多種微生物(沼氣細菌)分解有機物質產生沼氣的過程,叫沼氣發酵。沼氣產生的基本原理,就是厭氧機理,其發酵的生物化學過程,大致可分為液化、產酸、產甲烷三個階段。
第一階段(水解階段):有機物質(碳水化合物、蛋白質、脂肪等)由發酵細菌(纖維素分解細菌、蛋白質分解細菌、脂肪分解細菌等)的作用,將多糖水解成單糖,蛋白質水解成肽和胺基酸,脂肪水解成甘油和脂肪酸,並進一步降解成各種低級有機酸,如乙酸、丙酸、宜春等。同時,還生成氫氣和二氧化碳。
第二階段(產酸階段):主要是由產氫細菌和乙酸細菌,將丙酸、乙酸和乙醇等分解,形成氫和乙酸,間或有二氧化碳形成。
第三階段(產甲烷階段)產甲烷細菌分解乙酸,形成甲烷和二氧化碳,或利用氫還原二氧化碳,形成甲烷,或轉化甲酸形成甲烷。在形成的甲烷中,約30%來自氫還原二氧化碳,70%來自乙酸的分解。
沼氣發酵的三個階段是相互依賴和連續進行的,並保持動態平衡。在沼氣發酵初期,以第一、二階段的作用為主,也有第三階段的作用;在沼氣發酵後期,則是三個階段的作用同時進行,到一定時間,保持一定的動態平衡才能持續正常地產氣。
四、氣體液化的原因
氣體分子間存在引力,引力使氣體分子傾向彼此間吸引而聚集,但分子的熱運動又使它們傾向彼此分離、占有容器,而且不斷碰擊器壁,由於這兩種傾向存在,巨觀表現如何,要看哪一種傾向占有優勢。
當溫度相當高時,分子熱運動激烈,此時分子間平均距離大,氣體占有較大容積,即壓強較低,分子間的吸引力較弱,因此氣體分子的強烈運動可以克服分子間微弱的引力,故保持氣體狀態。
在降低溫度時,分子運動的平均動能減小,同時增加壓強,可增加分子間引力,這足以克服分子運動的動能,使它們彼此聚集起來,變成液態。
在溫度較高時,分子熱運動強烈,它們需要有更大的分子間引力才能克服分子熱運動的動能,這就要求減少分子間的平均距離,也就是要有更大的壓強。要使氣體液化單純靠增加壓力、縮小分子平均距離來增加分子間的吸引力是有限的;必須首先降低氣體溫度、減少分子的熱運動能量,再增加壓力才是有效的。但在臨界溫度以上靠加大壓強來使氣體液化是徒勞的。