胰澱粉酶 - 簡介
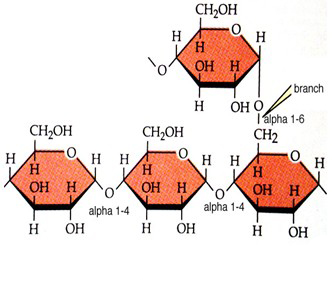
胰澱粉酶(pancreatic amylase)是由胰腺分泌的一種水解酶,是作用於可溶性澱粉、直鏈澱粉、糖原等α-1,4-葡聚糖,水解α-1,4-糖苷鍵的酶。屬於α-澱粉酶的一種。

α-澱粉酶廣泛分布於動物(唾液、胰臟等)、植物(麥芽、山萮菜)及微生物。微生物的酶幾乎都是分泌性的。此酶以Ca2+為必需因子並作為穩定因子,既作用於直鏈澱粉,亦作用於支鏈澱粉,無差別地切斷α-1,4-鏈。因此,其特徵是引起底物溶液粘度的急劇下降和碘反應的消失,最終產物在分解直鏈澱粉時以麥芽糖為主。此外,還有麥芽三糖及少量葡萄糖。另一方面在分解支鏈澱粉時,除麥芽糖、葡萄糖外,還生成分支部分具有α-1,6-鍵的α-極限糊精。一般分解限度以葡萄糖為準是35-50%,但在細菌的澱粉酶中,亦有呈現高達70%分解限度的(最終游離出葡萄糖)。
β-澱粉酶與α-澱粉酶的不同點在於從非還原性末端逐次以麥芽糖為單位切斷α-1,4-葡聚糖鏈。主要見於高等植物中(大麥、小麥、甘薯、大豆等),但也有報告在細菌、牛乳、黴菌中存在。對於象直鏈澱粉那樣沒有分支的底物能完全分解得到麥芽糖和少量的葡萄糖。作用於支鏈澱粉或葡聚糖的時候,切斷至α-1,6-鍵的前面反應就停止了,因此生成分子量比較大的極限糊精。從上述的α-澱粉酶和β-澱粉酶的作用方式,分別提出α-1,4-葡聚糖-4-葡萄糖水解酶(α-1,4-glucan 4-glucanohydrolase)和 α-1,4-葡聚糖-麥芽糖水解酶(α-1,4-glucan maltohydrolase)的名稱等而被使用。
胰澱粉酶由胰腺以活性狀態排入消化道,是最重要的水解碳水化合物的酶,和唾液腺分泌的澱粉酶一樣都屬於α-澱粉酶,作用於α-1,4糖苷鍵,對分支上的α-1,6糖苷鍵無作用,故又稱澱粉內切酶,其作用的最適pH為6.9,可通過腎小球濾過,是能在正常時於尿中出現的血漿酶。
人體的其他組織如卵巢、輸卵管、肺、睪丸、精液、乳腺等的提取物中都發現有澱粉酶活性;血液、尿液、乳液中也含澱粉酶。血液澱粉酶中主要來自胰腺、唾液腺,尿液中澱粉酶則來自於血液。
臨床意義
增高
見於胰腺腫瘤引起的胰腺導管阻塞、胰腺膿腫、胰腺損傷、
腸梗阻、胃潰瘍穿孔、
流行性腮腺炎、腹膜炎、膽道疾病、急性闌尾炎、膽囊炎、消化性潰瘍穿孔、腎功能衰竭或腎功能不全、輸卵管炎、創傷性休克、大手術後、肺炎、肺癌、急性酒精中毒、嗎啡注射後,以及口服避孕藥、磺胺、噻嗪類利尿劑、鴉片類藥物(可待因、嗎啡)、
麻醉止痛劑等。
減低
套用
了解血清胰澱粉酶在急性胰腺炎及其相關疾病中的變化規律,確定血清胰澱粉酶在急性胰腺炎診斷中的作用。方法:經臨床與影像學診斷的急性胰腺炎組60例;非急性胰腺炎組45例,包括急性膽囊炎30例,急性腮腺炎2例,胰腺癌5例,急性腸梗阻3例,慢性胰腺炎5例。分別於發病第2天行血清胰澱粉酶和血清總澱粉酶測定。結果:血清總澱粉酶和血清胰澱粉酶對急性胰腺炎診斷的敏感性可達100%,但特異性較差。血清總澱粉酶對急性胰腺炎診斷的特異性為64.5%,血清胰澱粉酶的特異性為80%,胰澱粉酶/總澱粉酶比值>64%的特異性為100%。
結論:不能單純依據血清總澱粉酶或胰澱粉酶的測定值來確定急性胰腺炎的診斷,胰澱粉酶/總澱粉酶比值>64%是診斷急性胰腺炎的敏感而可靠的生化指標。