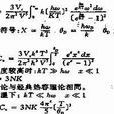熱容的定義
在不發生相變化和
化學變化的前提下,系統與環境所交換的熱與由此引起的
溫度變化之比稱為系統的熱容。系統與環境交換熱的多少應與物質種類、狀態、
物質的量和交換的方式有關。因此,系統的熱容值受上述各因素的影響。另外,溫度變化範圍也將影響熱容值,即使溫度變化範圍相同,系統所處的始、末狀態不同,系統與環境所交換的熱值也不相同。所以,由某一溫度變化範圍內測得的熱交換值計算出的熱容值,只能是一個平均值,稱為平均熱容。即
C平均=Q/ΔT
當溫度變化時,平均熱容就很難反映系統的真實狀態。為此提出了熱容的概念,其定義式為
C=δQ/dT
熱容的單位為J·K
-1,是系統的
廣度性質。1mol物質的熱容稱為摩爾熱容,以C
m表示,單位為J·mol
-1·K
-1,C=nC
m;單位質量物質的熱容稱為
比熱容。
熱容分類
熱容是一個
廣度量(廣延量),如果升溫是在體積不變條件下進行,該熱容稱為
等容熱容,如果升溫是在壓強不變條件下進行,該熱容稱為
等壓熱容。單位質量物體的熱容稱為
比熱容。設物體的溫度由T
1K升高至T
2K時吸熱為Q,則Q/(T
2-T
1)稱為T
1至T
2溫度間隔內的平均熱容(average heat capacity)。
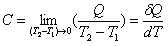 熱容公式
熱容公式由於物體在不同溫度時升高1K所需熱不同,因此在某一溫度T時物體的熱容C的嚴格定義是(見圖)lim代表T
2趨近於T
1的極限,δQ表示無限小量熱比區別於
狀態函式的全微如dT。
組成不變的均相封閉系統,系統吸收熱的多少與溫度升高的幅度成正比。熱力學規定:在不做非體積功的情況下,一個不發生化學變化和相變化的封閉系統,溫度每升高1℃所需要的熱稱為熱容(heat capacity)。用符號C表示,單位:J/K。
C=δQ/dT
在一定溫度區間ΔT內,系統吸收的熱Q與溫度變化幅度的比值稱為平均熱容。熱容不僅與系統的性質有關,還與系統中所含物質的數量有關。單位質量的物質溫度每升高1℃所需要的熱稱為比熱容,簡稱比熱,單位:J/(K·g)或J/(K·kg)。1mol物質溫度每升高1℃所需要的熱稱為摩爾熱容,用符號Cm表示,單位:J/(K·mol)或者J/(mol·K)。
因為熱與過程有關,所以系統的熱容也與過程有關。封閉系統恆容過程的熱容稱為
恆容熱容,用C
V表示,摩爾恆容熱容用符號C
V,m表示
CV=nCV,m=δQV/dT
在不做非體積功的情況下,
封閉體系的恆容過程δQ
V=dU。
由此可見,在無化學變化和相變且不做非體積功的過程中,恆容熱容又等於封閉系統的熱力學能隨溫度的變化率。從上式可得
dU=CVdT=nCV,mdT
利用上式可以計算封閉系統無化學變化和相變且不做非體積功的過程中的熱力學能變。若恆容熱容與溫度無關,則
ΔU=CV(T2-T1)=nCV,m(T2-T1)
同樣,封閉系統的
恆壓熱容用符號C
p表示,摩爾恆壓熱容用符號C
p,m表示,公式同上。
理論
物體在某一過程中,每升高(或降低)單位溫度時從外界吸收(或放出)的熱量。如傳遞的熱量為 ΔQ溫度改變ΔT時,物體在該過程中的熱容C被定義為其單位為 J/K。熱容同物質的性質、所處的狀態及傳遞熱量的過程有關,並同物質系統的質量成正比。可見,必須指明系統所經歷的過程,熱容才具有確定的值。熱容隨過程的不同而不同,它不是
狀態函式。對於一般的流體系統,如氣體、
液體,在實際問題中經常用到的是系統在
等壓過程和
等容過程的熱容,分別稱為定壓熱容C
p和定容熱容
C
V。
 熱容
熱容 熱容
熱容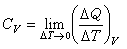 熱容
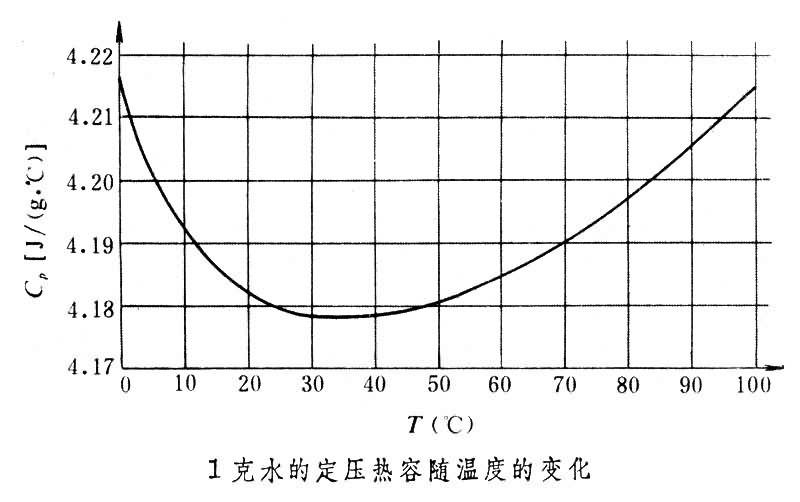
熱容對實際氣體和液體來說,定壓熱容不僅同溫度有關,還同所處的
壓強有關,因而C
p隨溫度T、壓強p而變化。與此相似, C
V隨溫度T、體積V而變化。當p或V一定時,熱容將只隨溫度變化。以水為例,在
標準大氣壓下,1克水溫度在 0~100℃之間其定壓熱容隨溫度的變化如下圖所示。套用
熱力學第一定律和熱力學
態函式,還可將C
p和Cv表示為如下的常用形式式中H和U為系統的態函式焓和內能。C
p和C
V均可由實驗測出,因為實驗裝置中固定壓強較為容易,所以通常測量的是定壓熱容,而
定容熱容是通過測量等壓膨脹係數
α 及
等溫壓縮係數 k,利用關係而得到(V 為物體的體積,T 為
熱力學溫度)。對氣體來說,還可測量出C
p和C
V的比值γ,套用γ=C
p/ C
V,計算得到C
V。
 熱容
熱容 熱容
熱容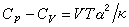 熱容
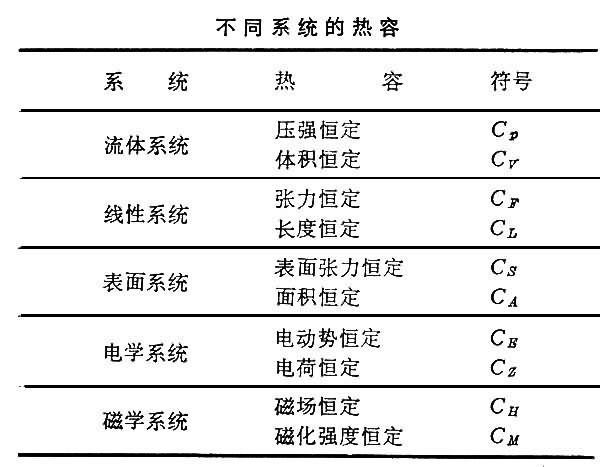
熱容各種不同的系統在一定條件下,有其各自的熱容,列表如下:表中每一種熱容均是兩個參量的函式,當狀態變化的範圍較小時,熱容實際上可視為常數。當溫度趨於
絕對零度時,各種物質的熱容都趨近於零。
 熱容
熱容對於單元二相系,還可以引入二相平衡熱容的概念。以C1表示相1的二相平衡熱容,其定義是在加熱過程中保持相1同相2平衡的條件下,使處於相1的物質溫度升高1K所吸收的熱量。C2表示相2的二相平衡熱容,即在加熱過程中保持相2同相1平衡,使處於相2的物質溫度升高1K所吸收的熱量。計算表明,一定質量水的二相平衡熱容同水的定壓熱容相差很少。
熱容與溫度的關係
熱容是溫度的函式,熱容值隨溫度變化範圍不同而不同。許多科學家用實驗方法精確測定了各種物質在各個溫度下的熱容值,求得了表示熱容與溫度關係的經驗表達式。通常採用的經驗公式有下列兩種形式。
Cp,m=a+bT+cT2
Cp,m=a+bT+cˊT-2
式中:a、b、c及cˊ均為經驗常數,隨物質的不同及溫度變化範圍的不同而異。各物質的熱容經驗公式中的常數值可參看附錄,或參看有關的參考書及手冊。
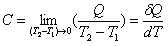 熱容公式
熱容公式 熱容
熱容 熱容
熱容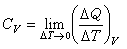 熱容
熱容 熱容
熱容 熱容
熱容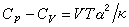 熱容
熱容 熱容
熱容