對於組成不變的均相封閉體系,不考慮非膨脹功,設體系吸熱Q,溫度從T1升高到T2,則恆容熱容:Cv=δQv/dT=(∂U/∂T)v。
基本介紹
- 中文名:恆容熱容
- 外文名:Constant capacity heat capacity
- 領域:熱力學
- 公式:Cv=δQ/dT
- 相關名詞:恆壓熱容
簡介


恆容熱容和恆壓熱容
定義
分類




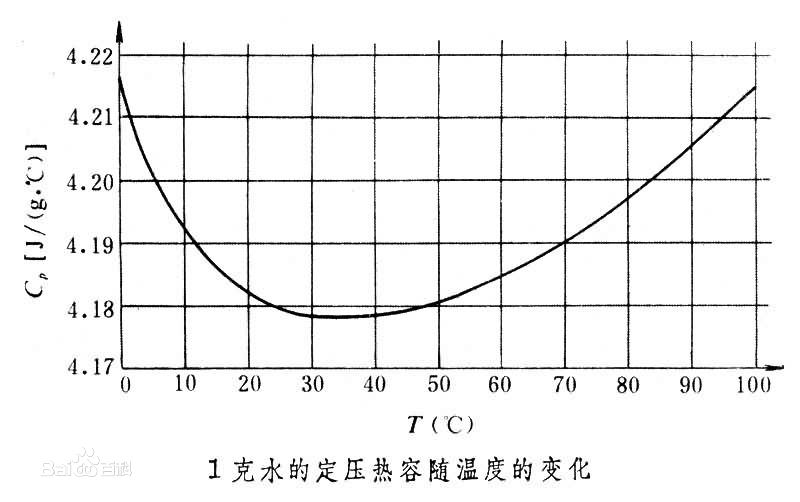



熱容與溫度的關係

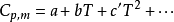
性質









對於組成不變的均相封閉體系,不考慮非膨脹功,設體系吸熱Q,溫度從T1升高到T2,則恆容熱容:Cv=δQv/dT=(∂U/∂T)v。











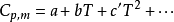









對於組成不變的均相封閉體系,不考慮非膨脹功,設體系吸熱Q,溫度從T1升高到T2,則恆容熱容:Cv=δQv/dT=(∂U/∂T)v。...
在不做非體積功的情況下,封閉體系的恆容過程δQV=dU。由此可見,在無化學變化和相變且不做非體積功的過程中,恆容熱容又等於封閉系統的熱力學能隨溫度的變化率...
對於組成不變的均相封閉體系,不考慮非膨脹功,設體系吸熱Q,溫度從T1升高到T2,則恆壓熱容:Cp=δQ/dT=(∂H/∂T)p。...
其中Cp為恆壓下的比熱,它套用於幾乎所有食品加熱和製冷加工上只有帶有氣體的食品計算時需要區別Cp和恆容比熱容Cv。M為食品質量(單位為kg)。中文...
二元溶液的熱容表示如下:式中n1、n2為兩組分的摩爾數;婔V1,婔V2和婔p1,婔p2分別表示兩組分在恆容和恆壓條件下的偏摩爾熱容,定義為: 溶液的熱容和比熱容可...
定壓比熱是恆定壓強下單位質量的物質升高1℃或1K所需吸收的熱量,其單位為卡/開·摩爾或焦耳/開·摩爾。中文名 定壓比熱 外文名 Specific Heat at Constant ...
邁耶公式,亦稱“邁耶方程”,舊譯“梅耶公式”。指明在相同溫度條件下,任何理想氣體的定壓比熱必大於其定容比熱,且兩者的差值恆等於一常數的關係式。是研究理想氣體...
格律乃森定律(Grüneisen law)是一個物理學定律,格律乃森從晶格振動的理論推導出材料體積膨脹係數與熱容間的關係式,即物體的熱膨脹係數與恆容熱容成正比,並且它們...
12、恆容熱容Cv: 一定量氣體,當體積保持不變,在沒有化學反應和相變的條件下,溫度改變1開爾文所吸收或放出的熱量,叫做恆容熱容。...
