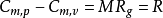邁耶公式,亦稱“邁耶方程”,舊譯“梅耶公式”。指明在相同溫度條件下,任何理想氣體的定壓比熱必大於其定容比熱,且兩者的差值恆等於一常數的關係式。是研究理想氣體熱物理性質的重要公式之一。
基本介紹
- 中文名:邁耶公式
- 外文名:Meyer formula
- 別名:邁耶方程
- 領域:熱力學
- 套用:工程熱力學、氣體動力學等
- 方程:Cp-Cv=nR
簡介,邁耶公式證明,
簡介
邁耶公式表明理想氣體的比定壓熱容恆大於比定容熱容,而且,雖然比定壓熱容和比定容熱容都是溫度的函式,但它們的差值確是常數。即


邁耶公式表明,儘管理想氣體的定壓比熱和定容比熱都隨溫度而變化,但兩者的差值不僅與壓力(或比容)無關,而且也與溫度無關。除在理想氣體的比熱理論中具有重要意義外,還廣泛套用於工程熱力學、氣體動力學等學科。
理想氣體的等壓、等體、等溫過程:

理想氣體準靜態過程的第一定律表達式:

等體過程:

等壓過程:
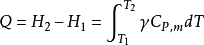
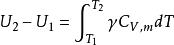
在等壓膨脹過程中,理想氣體所吸收熱量,一部分用於增加氣體的內能,另一部分用於氣體
對外作功,這正是定壓摩爾熱容大於定容摩爾熱容的原因。
對外作功,這正是定壓摩爾熱容大於定容摩爾熱容的原因。
邁耶公式證明

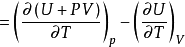
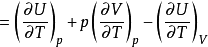
根據複合函式的偏微商公式:

代入上式,得:
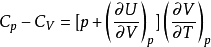
對理想氣體,

故,
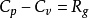
式兩邊都乘以相對分子質量M得: