基本介紹
- 中文名:活化能
- 外文名:Activation energy
- 又稱:閾能
- 學科:化學
歷史由來
萌芽
提出
完善
基本定義
化學反應
 活化能原理
活化能原理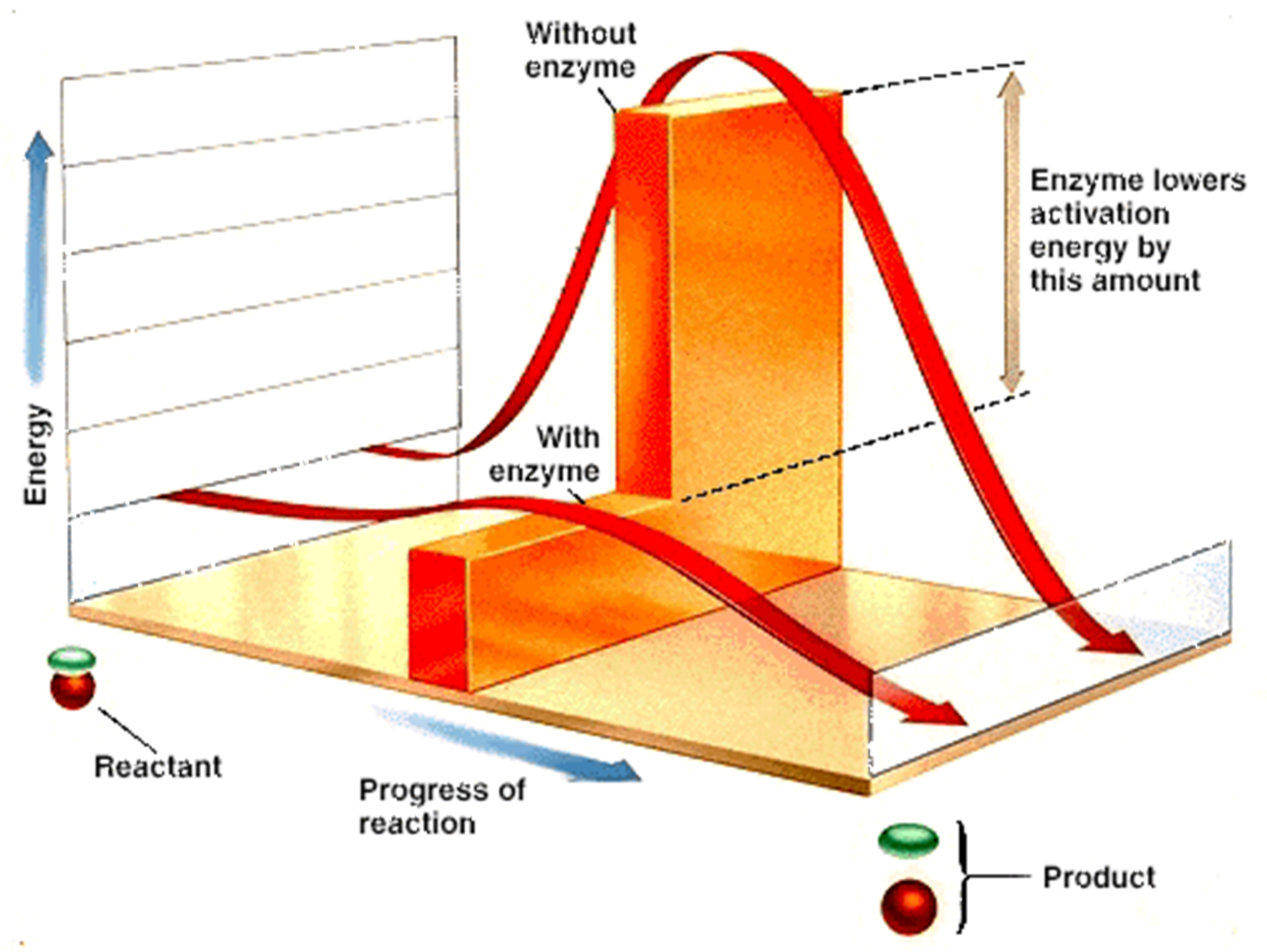
 活化能原理
活化能原理活化能是指分子從常態轉變為容易發生化學反應的活躍狀態所需要的能量。 (阿倫尼烏斯公式中的活化能區別於由動力學推導出來的活化能,又稱阿倫尼烏斯活化能或經驗活化...
反應活化能是指分子從常態轉變為容易發生化學反應的活躍狀態所需要的能量。 對基元反應,反應活化能即基元反應的活化能。對複雜的非基元反應,反應活化能是總包反應...
表觀活化能的概念最早是針對Arrhenius(阿倫尼烏斯)公式k=Ae-Ea/RT中的參量Ea提出的,是通過實驗數據求得,又叫實驗活化能。...
分子活化能是指分子從常態轉變為容易發生化學反應的活躍狀態所需要的能量。 (阿倫尼烏斯公式中的活化能區別於由動力學推導出來的活化能,又稱阿倫尼烏斯活化能或經驗...
吸附活化能a}ti}=anon energy of adsorption在體系能量對吸附質到固體表面距離的勢能曲線上,分子吸附(物理吸附)勢能曲線與各個原子吸附(解離化學吸附)勢能曲線的...
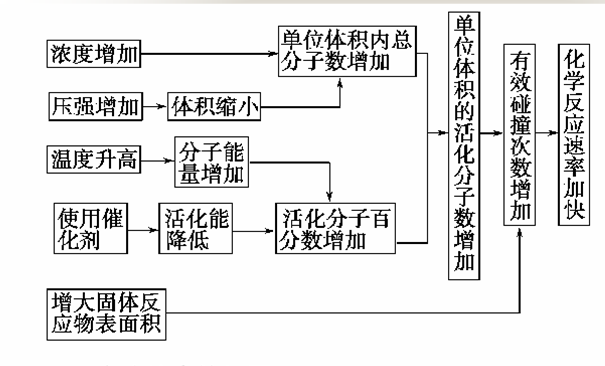
在化學反應中,反應物之間要能發生化學反應,首先它們的分子等微粒間必須發生相互碰撞。實驗證明,在無數次分子間的碰撞中,大多數的碰撞是無效的;只有其中少數分子間...
簡介 已化學吸附的物質轉變為物理吸附並進而從固體表面脫附聽必須具有的能量。脫附活化能理論上是化學吸附熱與吸附活化能之和。 ...
活化分子是指具有發生化學反應所需最低能量狀態的分子。分子之間發生化學反應,首先必須互相接觸(或碰撞)但並非每次碰撞都能發生反應,只有能量較大的分子互相碰撞才能...
在受動力學限制的化學反應中,活化能 Ea 為活化碰撞的平均摩爾能量與所有碰撞的平均摩爾能量之差;而能壘E為活化絡合物與反應物的零點能之差。...
降低反應活化能在任何化學反應中,反應物分子必須超過一定的能閾,成為活化的狀態,才能發生變化,形成產物。這種提高低能分子達到活化狀態的能量,稱為活化能。催化劑的...
式中,A稱為指前因子或表觀頻率因子,其單位與k相同;Ea稱為阿累尼烏斯活化能(簡稱活化能),其單位為kJmol-1。上述三式是定量表示k與T之間的關係。常用於...
阿瑞尼斯方程式提供了反應進行中反應速率和活化能之關係的定量基礎。 [1-2] 反應速率常數化學反應速率 編輯 反應速率即化學反應進行的快慢,單位為mol/(L·s)或...
激活能就是使晶體原子離開平衡位置遷移到另一個新的平衡或非平衡位置所需要的能量。亦稱為“活化能”。為了開始某一物理化學過程 (例如塑性流動、原子擴散、化學...
阿倫尼烏斯公式k=A·exp(-Ea/RT)中,k、R、T、Ea分別是化學反應速率常數、摩爾氣體常數、反應溫度及活化能,式中的A稱為指前因子。它是一個只由反應本性決定...
反應能壘rcartion energy barrier;acti}"aLi}r} ei}}rgy barri- 又稱活化能壘。勢能剖面圖卜以勢能曲線能量最低點為 能量零點時的反應能壘,以符號。b表示、...
k為速率常數,R為摩爾氣體常量,T為熱力學溫度,Ea為表觀活化能,A為指前因子(也稱頻率因子)。 該定律除對所有的基元反應適用外,對於一大批(不是全部)複雜反應...
過渡態是指反應物體系轉變成產物體系過程中,經過的能量最高狀態(或稱活化絡合物)。過渡態鍵的狀況是:舊鍵未完全斷裂,新鍵未完全形成。過渡態是不穩定的,不能...
由於其分子很容易發生分裂反應,形成活化能很高的分子,所以在高分子化學自由基聚合中作為引發劑來使用AIBN使用方法 編輯 偶氮二異丁腈(AIBN)是最常用的一種偶氮類...
碰撞理論直觀地說明了反應速率與活化能的關係,但沒有從分子內部原子重新組合的角度揭示活化能的物理意義。隨著人們對原子分子內部結構認識的深入,1935年 ,艾林(H. ...
