基本介紹
- 中文名:活化分子
- 外文名:activated molecule
- 影響因素:反應物的濃度、溫度、催化劑等
簡介,反應機制,影響因素,
簡介
能量高於某一臨界值(低限能量) 的分子叫活化分子。能量低於這個值的分子叫非活化分子或普通分子。分子在運動和碰撞過程中,分子之間不斷發生能量交換,使每個分子的能量均在瞬息萬變。因此,即便是同類分子,能量相差也很大。這種能量差別使分子分成活化分子和非活化分子。
活化分子和非活化分子並非一成不變。因分子碰撞使有些活化分子會失去能量,變成非活化分子; 而非活化分子可能在碰撞中得到能量,變成活化分子。但在一定溫度下,活化分子的數目 (或活化分子所占的百分率) 是不變的。
活化分子比普通分子高出的能量來源於分子的碰撞動能。同一體系中不同種分子活化時所需的能量不同,因此,某種分子活化時,另一種分子不一定被活化。
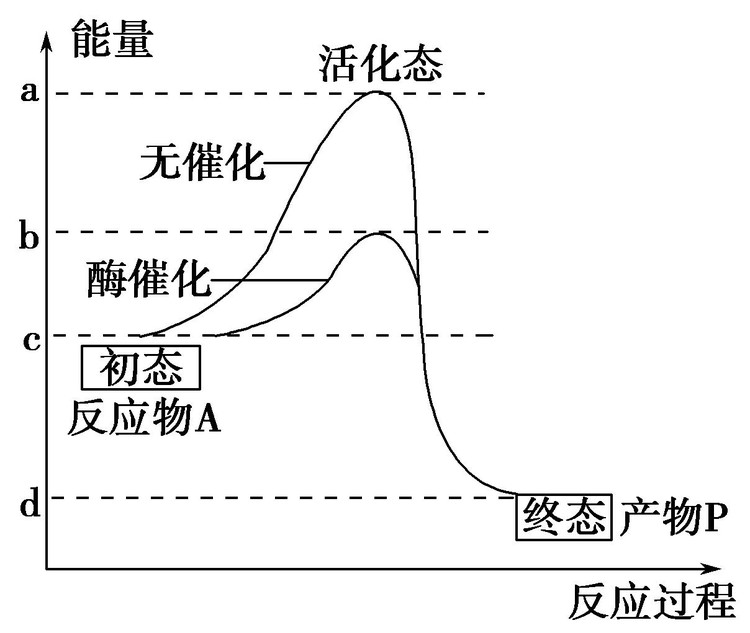
反應機制
在相同溫度下,分子的能量並不完全相同,有些分子的能量高於分子的平均能量,稱為活化分子。能夠發生有效碰撞的一定是活化分子,但是活化分子不一定發生有效碰撞。不是反應物分子之間的任何一次直接作用都能發生反應,只有那些能量相當高的分子之間的直接作用才能發生反應。在一定溫度下,某反應具有的活化分子數由該反應的活化能Ea決定。根據玻耳茲曼能量分布定律可知,能量大於Ea的分子占總分子數中的分數可用e-Ea/RT估算。活化分子數(或濃度)是決定化學反應速率的重要因素。對某一給定的化學反應,當溫度(T)升高時,e-Ea/RT的值增大,活化分子所占的比例增大,反應速率也就增大。使用催化劑能降低反應活化能,使得具有平均能量的反應物分子只要吸收較少的能量就能變成活化分子,有利於增大化學反應速率。
1、增加濃度,因為在一定溫度下活化分子占分子總數的百分比是固定的;
2、升高溫度,增加分子能量;
影響因素
活化分子濃度 (即活化分子數占總分子數的分數)的大小,對反應速度起決定性作用,活化分子濃度愈大,反應速度愈大。它還與反應物的濃度、溫度、催化劑等因素有關。一般反應物濃度愈大、溫度愈高,活化分子濃度就愈大。催化劑是通過改變反應活化能而影響活化分子濃度的。
活化分子百分數 | 分子總數 | 活化分子數 | ||
濃度增大 | 不變 | 增大 | 增大 | |
壓強增大 | 不變 | 不變 | 不變 | 單位體積內活化分子數增大 |
溫度升高 | 增大 | 不變 | 增大 | 能量升高 |
加入催化劑 | 增大 | 不變 | 增大 | 改變反應過程,降低活化能 |