基本介紹
- 中文名:化學反應碰撞理論
- 外文名:Chemical reaction collision theory
- 提出者:路易斯
- 提出時間:1918
- 套用學科:物理、化學
相關定義
有效碰撞
 有效碰撞
有效碰撞活化分子和活化能
 活化能的表示
活化能的表示提出過程
基本內容
在化學反應速率影響因素分析中的套用
 化學反應碰撞理論與化學反應速率分析
化學反應碰撞理論與化學反應速率分析濃度對化學反應速率的影響
壓強對化學反應速率的影響
 壓強對化學反應速率的影響
壓強對化學反應速率的影響溫度對化學反應速率的影響
催化劑對化學反應速率的影響
 催化劑對化學反應速率的影響
催化劑對化學反應速率的影響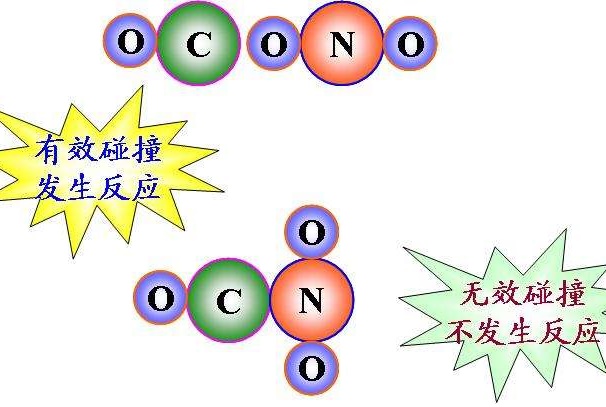
 有效碰撞
有效碰撞 活化能的表示
活化能的表示 化學反應碰撞理論與化學反應速率分析
化學反應碰撞理論與化學反應速率分析 壓強對化學反應速率的影響
壓強對化學反應速率的影響 催化劑對化學反應速率的影響
催化劑對化學反應速率的影響化學反應碰撞理論是在氣體分子動理論的基礎上發展起來的,該理論認為,發生化學反應的先決條件是反應物分子的碰撞接觸,但是並非每一次碰撞都能導致反應發生,反應物分子...
粒子多種多樣使碰撞理論分為:原子的碰撞、電漿的碰撞等等。同屬於粒子間的...有新物質生成的過程稱為化學反應,簡稱反應。例如,輕原子核(含氫H的同位素)的聚合...
simple collision theory;SCT 套用經典力學研究基元反應的化學動力學反應速率的理論。1 其理論要點(假設)可歸結為:(1)反應物分子是硬球;(2)反應發生必須進行碰撞...
《化學反應動力學》是2005年1月化學工業出版社出版的圖書,作者是許越。...... 本書以化學反應動力學的唯象理論為出發點,從巨觀到微觀比較全面地介紹了化學反應動力...
碰撞理論直觀地說明了反應速率與活化能的關係,但沒有從分子內部原子重新組合的角度揭示活化能的物理意義。隨著人們對原子分子內部結構認識的深入,1935年 ,艾林(H. ...
化學反應速率定義為單位時間內反應物或生成物濃度的變化量的正值。 [2] 稱為...則一般說來碰撞理論對溶液中的反應也是適用的,並且對於同一反應無論在氣相中或...
2.化學反應中的反應速率與化學計量數的關係在反應2NaOH+H2SO4=Na2SO4+2H2O...碰撞理論:把能夠發生化學反應的碰撞叫做有效碰撞,把能夠發生有效碰撞的分子叫做...
化學變化過程中總伴隨著物理變化。在化學變化過程中通常有發光、放熱、也有吸熱現象等。按照原子碰撞理論,分子間發生化學變化是通過碰撞完成的,要完成碰撞發生反應的分...
反應臨界能。ri}ical energy of rracainn簡單碰撞理論 中,導致化學反應所需在聯心線上的相對平動能分量的最小 值,符號。...
有效碰撞微觀的認知方式:化學反應原理,即通過活化分子之間的撞擊產生新物質的過程...有效碰撞理論來自對事物發展規律的觀察和總結,通過碰撞運動方式解讀和認知這個世界...
《燃燒理論基礎》以深入淺出的表達方法,介紹各種燃燒問題的分析和處理方法,注重講解各種基本燃燒現象的物理和化學本質。在數學處理上力求簡單、明了、易懂,使初學者...
自由電子碰撞碰撞理論 編輯 碰撞理論研究的是粒子間的一種相互作用。力學理論基礎...有新物質生成的過程稱為化學反應,簡稱反應。例如,輕原子核(含氫H的同位素)的...
