定義
氮循環是指氮在自然界中的循環轉化過程,是
生物圈內基本的
物質循環之一,如大氣中的氮經微生物等作用而進入土壤,為動植物所利用,最終又在微生物的參與下返回大氣中,如此反覆循環,以至無窮。
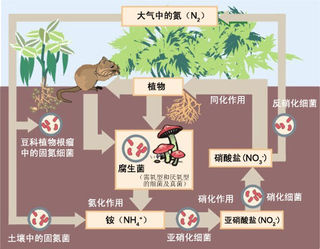
植物吸收土壤中的銨鹽和
硝酸鹽,進而將這些
無機氮同化成植物體內的蛋白質等有機氮。動物直接或間接以植物為食物,將植物體內的有機氮同化成動物體內的有機氮,這一過程為生物體內有機氮的合成。動植物的遺體、排出物和殘落物中的有機氮化合物被
微生物分解後形成氨,這一過程是
氨化作用。在有氧的條件下,土壤中的氨或銨鹽在
硝化細菌的作用下最終氧化成硝酸鹽,這一過程叫做
硝化作用。
氨化作用和硝化作用產生的無機氮,都能被植物吸收利用。在
氧氣不足的條件下,土壤中的硝酸鹽被反硝化細菌等多種微生物還原成亞硝酸鹽,並且進一步還原成分子態氮,分子態氮則返回到大氣中,這一過程被稱作
反硝化作用。
固氮作用(nitrogen fixation) 是分子態氮被還原成氨和其他含氮化合物的過程。自然界氮(N
2)的固定有兩種方式:一種是非
生物固氮,即通過閃電、高溫放電等
固氮,這樣形成的
氮化物很少;二是生物固氮,即分子態氮在生物體內還原為氨的過程。大氣中90%以上的分子態氮都是通過
固氮微生物的作用被還原為氨的。由此可見,由於微生物的活動,土壤已成為氮循環中最活躍的區域。
基本內容
氮(N)是天然濕地生態系統中最重要的組成成分和一種重要的生態影響因子,其主要來源有徑流輸入、大氣沉降和生物固氮。天然濕地中N的遷移和轉化主要發生在濕地演替帶,演替帶是生物地球化學活動比較強烈的緩衝區,常被視為濕地的N源、N匯和N轉化器。演替帶中N衰減主要是通過反硝化、厭氧氨氧化和濕地植被吸收等方式進行。
空氣中含有大約78%的氮氣,占有絕大部分的氮元素。氮是許多生物過程的基本元素;它存在於所有組成蛋白質的胺基酸中,是構成諸如DNA等的核酸的四種基本元素之一。在植物中,大量的氮素被用於製造可進行光合作用供植物生長的葉綠素分子
加工,或者固定,是將
氣態的
游離態氮轉變為可被有機體吸收的
化合態氮的必經過程。一部分
氮素由閃電所固定,同時絕大部分的氮素被非共生或共生的固氮細菌所固定。這些細菌擁有可促進氮氣氫化成為氨的固氮酶,生成的氨再被這種細菌通過一系列的轉化以形成自身組織的一部分。某一些固氮細菌,例如根瘤菌,寄生在豆科植物(例如豌豆或蠶豆)的根瘤中。這些細菌和植物建立了一種
互利共生的關係,為植物生產氨以換取糖類。因此可通過栽種豆科植物使氮素貧瘠的土地變得肥沃。還有一些其它的植物可供建立這種
共生關係。
其它植物利用根系從土壤中吸收
硝酸根離子或
銨離子以獲取氮素。動物體內的所有氮素則均由在
食物鏈中進食植物所獲得。
硝化作用
產生的氨,一部分被微生物固持及植物吸收,或者被粘土礦物質固定;另一部分通過自養硝化或異養硝化轉變成硝酸鹽,這一過程被稱為硝化作用。
氨來源於
腐生生物對死亡動植物器官的分解,被用作製造銨離子(NH
4+)。在富含氧氣的土壤中,這些離子將會首先被亞
硝化細菌轉化為亞
硝酸根離子(NO
2-),然後被硝化細菌轉化為硝酸根離子(NO
3-)。銨的兩步轉化過程被叫做
硝化作用。
銨離子很容易被固定在土壤尤其是腐殖質和粘土中。而硝酸根離子和
亞硝酸根離子則因它們自身的負電性而更不容易被固定在
正離子的交換點(主要是腐殖質)多於負離子的土壤中。在雨後或灌溉後,流失(可溶性離子譬如
硝酸根和亞硝酸根的移動)到地下水的情況經常會發生。地下水中
硝酸鹽含量的提高關係到飲用水的安全,因為水中過量的硝酸根離子會影響嬰幼兒血液中的氧濃度並導致
高鐵血紅蛋白症或藍嬰綜合徵(Blue-baby Syndrome)。如果地下水流向溪川,富硝酸鹽的地下水會導致地面水體的
富營養作用,使得藍藻菌和其它藻類大量繁殖,導致水生生物因缺氧而大量死亡。雖然不像銨一樣對魚類有毒,硝酸鹽可通過富營養作用
間接影響魚類的生存。氮素已經導致了一些水體的
富營養化問題。從2006年起,在英國和美國使用氮肥將受到更嚴厲的限制,
磷肥的使用也將受到了同樣的限制。
在無氧(低氧)條件下,厭氧細菌的“
反硝化作用”將會發生。最終將硝酸中氮的成分還原成氮氣歸還到大氣中去。
氮氣轉化
有三種將游離態的N
2(大氣中的
氮氣)轉化為
化合態氮的方法:
生物固氮:是指固氮微生物將大氣中的氮氣轉換成氨的過程,一些共生細菌(主要與豆科植物共生)和一些非共生細菌能進行
固氮作用並以
有機氮的形式吸收。
工業固氮:在
哈伯-博施法中,N
2與氫氣被化合生成氨(NH
3)肥。
化石燃料燃燒:主要由交通工具的引擎和熱電站以NO
x的形式產生。
另外,閃電亦可使N
2和O
2化合形成NO,是
大氣化學的一個重要過程,但對陸地和水域的氮含量影響不大。
固氮作用
人為干預
人為的固氮作用,即化學氮肥的生產和套用,大規模種植豆科植物等有生物固氮能力的作物,以及燃燒礦物燃料生成NO和NO
2。人為的
固氮量是很大的,估計約占全球年總固氮量的20~30%。隨著
世界人口的增多,這一比例將會繼續上升。
農田大量施用氮肥,使排入大氣的N
2O不斷增多。在沒有人為干預的自然條件下,
反硝化作用產生並排入大氣的N
2和N
2O,與
生物固氮作用吸收的N
2和平流層中被破壞的N
2O是
相平衡的。N
2O是一種惰性氣體,在大氣中可存留數年之久。它進入平流層大氣中以後,會消耗其中的臭氧,從而增加到達地面的紫外線輻射量。這可能會給人體健康帶來有害影響,對此還不很清楚。施用氮肥的農田排出的地面徑流,城市和農村的生活污水都把大量的氮排入河流、湖泊和海洋,常常造成這些水體的
富營養化現象。
礦物燃料燃燒時,空氣中和燃料中的氮在高溫下與氧反應而生成
氮氧化物(NO和NO
2)。大氣受到氮氧化物的污染,是發生
光化學煙霧和酸雨的一個重要原因。
污染防治
氮是植物營養的三要素之一,也是人和動物的營養物質成分,空氣中的氣體四分之三是
氮氣,但氮的存在形式多樣,它們的轉換和利用都很複雜。我們常見的是化學合成肥料氮,它們進入農田後,一部分與進入土壤中的動植物殘體及人和動物的排泄物中的氮一起,經歷由微生物驅動的各種轉化過程,形成多種含氮氣體。其中有些可直接遷移到水體,過量的氮化物,導致水體
氮污染,不僅危害人體健康,而且成為
水體富營養化的一個因子。二氧化氮還是一種重要的溫室氣體,進入大氣後增強溫室效應。僅此可見,氮不僅是生命必需的元素,也關係到人類生存環境。
氮失衡的原因
自然界中以
氮氣形態存在的氮稱為
惰性氮,對
生態環境沒有負面影響,在生產工業化以前,氮循環系統中,氮的收支是平衡的,即
固氮作用和
脫氨作用基本持平。當氮通過化學工業合成或燃燒後,就會被活化,形成
氮氧化物和氮
氫化物等物質,即加強了固氮作用。氮活化的途徑有三:一是
人工固氮,將空氣中的氮氣轉化為氨;二是工業生產中燃燒煤、石油、天然氣等;三是固氮植物的作用。在循環系統中,氮收支是否平衡會關係到
活性氮對人類健康和生存環境積極或消極的影響。氮的過量“活化”,便使自然界原有的固氮和
脫氨失去平衡,氮循環被嚴重擾亂,越來越多的活化氮開始向大氣和水體過量遷移,循環開始出現病態,導致
全球環境問題。20世紀70年代以來,人類對
生態系統中的
氮素循環進行了廣泛而深入的研究。SCOPE(國際科委環境委員會)將全球氮超載作為一個潛在的環境問題和化學定時炸彈提出。
氮缺乏的危害
氮是植物正常生長發育所必需的營養元素之一,所以也是提高生產能力的主要
限制因子。在農業生態中,如果缺少
活性氮就會導致土壤肥力下降、產量下降、蛋白質含量降低、土壤有機質耗竭、土壤侵蝕,甚至沙漠化;在濕潤的熱帶,土壤遭受強烈的風化和淋溶,土壤養分貧瘠,土壤氮素和磷素成為受限的營養元素。因此,我們要適當增強土壤中的氮肥力,促進農業的可持續發展,保障糧食安全(足夠的熱量)和營養安全(提供相應所有必需的養分,包括蛋白質)。
氮污染的危害
(1)由氮轉化的氨在微生物的作用下,會形成
硝酸鹽和酸性氫離子,造成土壤和水體生態系統酸化從而使生物多樣性下降。另外,銨對於魚類來說有劇毒,因此必須對
廢水處理且植物排放到水中的銨的濃度進行嚴密的監控。為避免魚類死亡的損失,應在排放前對水中的銨進行硝化處理,在陸地上為硝化細菌通風提供
氧氣進行硝化作用成為一個充滿吸引力的解決辦法。
(2)水體中氮素過多導致
富營養化。
水體富營養化的後果,首先是破壞水資源,降低水的使用價值,直接影響人類的健康,同時提高水處理的成本;其次是導致魚類及水生動物的大量死亡,破壞水產資源,引發“
藻華”和“
赤潮”等現象。
(3)溫室效應和酸雨。一氧化二氮這種氮氧化物吸收紅外線輻射的能力特彆強,是二氧化碳的200多倍,是導致溫室效應的可怕殺手。
氧化亞氮(俗稱笑氣)除了產生溫室效應外,還可以在大氣中與
臭氧發生化學反應,擾亂臭氧層,增加地表的紫外線強度,危害人體健康。一氧化氮、
二氧化氮還是酸雨的成分之一。
(4)NO
2-誘發各種疾病乃至致癌。人們一旦從受污染的瓜果蔬菜和飲用水中攝取過量的硝酸鹽,高血壓、先天性
中樞神經系統殘疾和非霍金氏淋巴瘤就有可能發生。早在1945年,Comly就報導了嬰兒體內由於飲用水中高含量
硝態氮而影響嬰幼兒血液中的氧濃度並導致
高鐵血紅蛋白症或藍嬰綜合徵(Blue-baby Syndrome);燃燒
化石燃料所產生的
氮氧化物形成地面
臭氧,會引發哮喘。大量醫學研究報導證明,肝癌、胃癌等症的發病率也與人體攝入的硝酸鹽量密切相關。
(5)社會問題。市政當局必須面臨地下水和飲用水中NO3-超標、醫療費用增加等社會問題。在農田附近的農村,飲用水井NO3-含量超標也是一個難題。
控制措施
氮對我國及世界環境造成了多方面影響,我們應採用科學的措施和政策,遏制氮對環境與生態的破壞。我國是農業大國,70%的活化氮來自於農業生產,最根本的方法是合理施肥,提高氮肥利用效率。因此,改革現有耕作制度、推廣精確施肥、加強
農業技術推廣體系建設是關鍵。在工業生產過程中,提高能源利用率或減少含氮物的生成量,也可對固定排放源採用催化還原、吸收、吸附等技術,控制、回收或利用廢物中的
氮氧化物,使其達到無害化排放。排放廢水時,銨的濃度要進行嚴密的監控,應在排放前進行硝化處理。另外,監測
規模化養殖場,禁止其隨意向湖泊、河道中排放氮污染物等。