晶格能是指在標準狀況下,使離子晶體變成氣態正離子和氣態負離子時所吸收的能量,它是度量晶格穩定性的參數。影響晶格能大小的因素有離子半徑、離子電荷以及離子的電子層構型等.電荷高、半徑小的離子,其晶格能大。
基本介紹
定義,公式,計算方法,穩定性,影響因素,離子半徑,離子電荷,電子構型,注意事項,
定義
公式
用化學反應式表示時,相當於下面反應式的焓變的值。
MaXb(s) →aMz+(g)+bXz-(g) U=ΔH
計算方法
晶格能的數值有兩個來源:
第一是理論計算值。它是根據離子晶體模型,考慮其中任一離子跟周圍異號離子間的吸引作用,以及跟其他同號離子間的排斥作用推導出下列近似公式計算得到的。
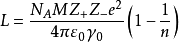
式中NA是阿伏伽德羅常數,Z是離子價數,r0是一對離子間的平均距離,M是跟晶格類型有關的馬德隆常數,ε0是真空電容率(8.85419×10-12庫-2·牛-1·米-2),n為伯恩常數,它的值可取5~12。例如,氯化鈉晶體的Z+=Z-=1,r0=2.814×10-10m,M=1.7476,n=8,代入上述公式可得U=755kJ/mol。
穩定性
離子化合物都有較高的熔點和沸點,這是和它們離子晶體有很大的晶格能有關。由於UMgO>UNaF,MgO的熔點(2800℃)比NaF的熔點(988℃)高得多。
晶格能越大,表示離子鍵越強,晶體越穩定。
晶格能越大,熔化或破壞離子晶體時消耗的能量就越大,相應的熔點就越高,硬度就較大。亞銅離子為18電子構型,鈉離子為8電子構型,亞銅離子的極化作用大於鈉離子,所以共價鍵成分更多,晶格能更小,熔沸點更低。因此Cu2S<Na2S。
影響因素
影響晶格能大小的因素主要是離子半徑、離子電荷以及離子的電子層構型等。