2014年7月29日,國家食品藥品監督管理總局以食藥監藥化監〔2014〕135號印發《中藥提取物備案管理實施細則》。該《實施細則》共16條。
根據《中藥提取物備案管理實施細則》完成生產提取物備案的將獲得提取物生產備案號。
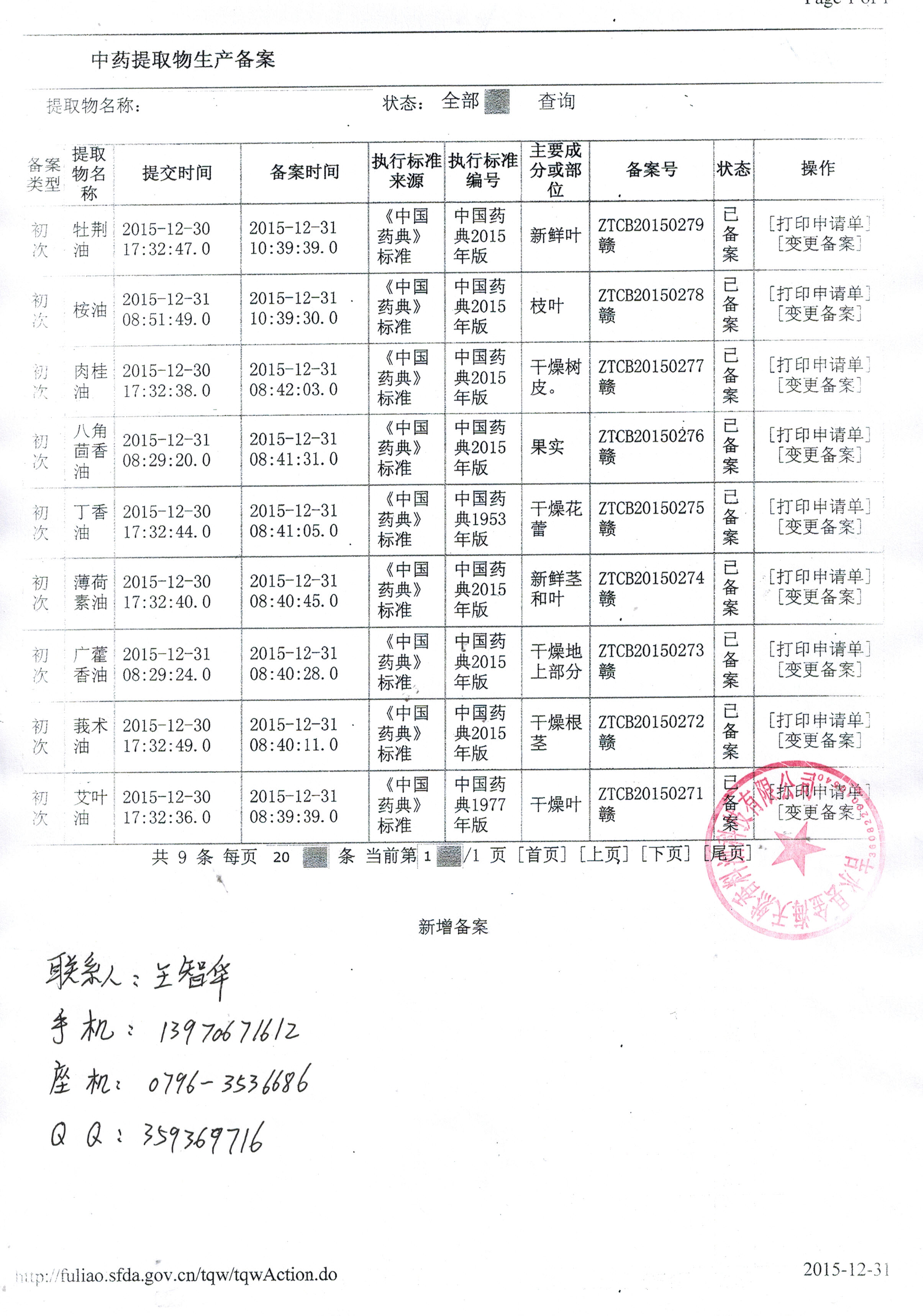
2014年7月29日,國家食品藥品監督管理總局以食藥監藥化監〔2014〕135號印發《中藥提取物備案管理實施細則》。該《實施細則》共16條。
根據《中藥提取物備案管理實施細則》完成生產提取物備案的將獲得提取物生產備案號。
2014年7月29日,國家食品藥品監督管理總局以食藥監藥化監〔2014〕135號印發《中藥提取物備案管理實施細則》。該《實施細則》共16條。根據《中藥提取物備案管理實施...
和人員編制規定的通知》(國辦發〔2013〕24號)的相關規定,現就調整化妝品備案...6.使用動物臟器組織及血液製品提取物的原料,應當收集該原料的來源、質量規格和原料...
2014年7月29日,國家食品藥品監督管理總局以食藥監藥化監〔2014〕135號印發《中藥提取物備案管理實施細則》。該《實施細則》共16條。...
產品名稱 備案編號 備案日期 生產企業 成分 草本萃取髮根舒醒精華液 滬G妝網備字2018032728 2018-12-06 英姿(上海)化妝品有限公司 何首烏提取物,側柏葉提取物,...
九展茶油滋養洗髮水主要成份:水;油茶(CAMELLIA OLEIFERA)籽提取物;油茶(CAMELLIA...備案編號 閩G妝網備字2016002055生產企業 福建春輝生物工程有限公司九展九展茶油...
成分:水、甘油、桑(MORUSALBA)根皮提取物、黃芩(SCUTELLARIABAICALENSIS)提取物、...衛生許可證:GD▪FDA(2010)衛妝準字29-XK-3352號 [1] 備案編號 粵G妝網...
芸蓉集慕曉皙康潤膏 [1] 備案編號 粵G妝網備字2017038349 [1] ...提取物,黃連(COPTIS CHINENSIS)提取物,黃檗(PHELLODENDRON AMURENSE)提取物,地膚子...
國產非特殊用途化妝品備案編號粵G妝網備字2019051272 [1] 安幕茵驕陽離子霜產品成分 編輯 主要成分"水","庫拉索蘆薈(ALOE BARBADENSIS)葉提取物","牛油果樹(...
申請/註冊號:21200917 申請日期:2016年09月05日 ...月見草油;燕麥仁油;角鯊烷;海藻糖;歐百里香提取物;...5. 極地雪絨花肌底修護面膜·備案信息 .國家非特殊...
國家藥監局備案編號: 京G妝網備字2019000229 [1] 產品備案成分列表:著妍明星美肌煥膚霜 [1] ["水","甘油","太子參(PSEUDOSTELLARIA HETEROPHYLLA)提取物","...
主要成分:向日葵籽油不皂化物、長柔毛薯蕷根提取物...申請成功 [17] (萃蒔禮商標註冊證號:21004229) [...10. 萃蒔禮酵素煥膚補水修護面膜國家藥監局備案信息...
備案編號 :浙G妝網備字2015007190備案日期:2015-07-02委託方: 杭州虞美人健康...水,丁二醇,甘油硬脂酸酯,稻米發酵產物濾液,酵母發酵產物提取物,乳酸桿菌/南瓜...
國家藥監局備案號:京G妝網備字2019000227 [1] 產品備案成分列表:著妍麗效祛痘修護霜 [1] ["水","甘油","互生葉白千層(MELALEUCA ALTERNIFOLIA)葉提取物","...
備案編號:京G妝網備字2017001491[1] 備案日期 :2017-03-17[1] 生產企業:進...果提取物,女貞(LIGUSTRUM LUCIDUM)果提取物,山柰(KAEMPFERIA GALANGA)根提取物,...
(EUTERPE OLERACEA)果提取物;透明質酸鈉;果膠;黃原膠;皺波角叉菜(CHONDRUS ...U牌儲水面膜是上海依步實業有限公司生產的一個產品,產品備案衛生許可證號:滬妝...
