惡性腎小動脈硬化是由惡性高血壓引起的一種惡性疾病。惡性高血壓部分由原發性高血壓進展而來,另一部分則發生於繼發性高血壓,主要為腎實質性病變(慢性腎盂腎炎、急慢性腎小球腎炎)和腎血管性高血壓。腎臟是惡性高血壓最易累及的靶器官,表現為惡性小動脈性腎硬化症,病情兇險,不及時治療很快進入腎功能衰竭,可導致80%患者在兩年內死亡,故應引起廣大醫務人員的重視。
病症原因
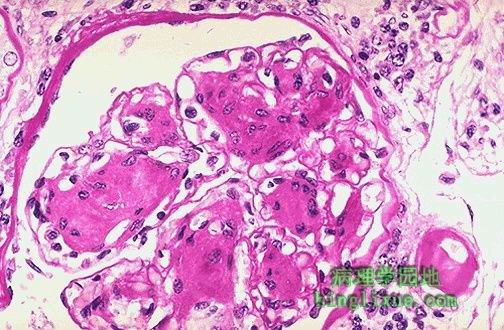
病症診斷
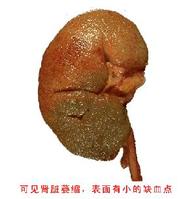
惡性腎小動脈硬化是由惡性高血壓引起的一種惡性疾病。惡性高血壓部分由原發性高血壓進展而來,另一部分則發生於繼發性高血壓,主要為腎實質性病變(慢性腎盂腎炎、急慢性腎小球腎炎)和腎血管性高血壓。腎臟是惡性高血壓最易累及的靶器官,表現為惡性小動脈性腎硬化症,病情兇險,不及時治療很快進入腎功能衰竭,可導致80%患者在兩年內死亡,故應引起廣大醫務人員的重視。


惡性腎小動脈硬化是由惡性高血壓引起的一種惡性疾病。惡性高血壓部分由原發性高血壓進展而來,另一部分則發生於繼發性高血壓,主要為腎實質性病變(慢性腎盂腎炎、急...
腎動脈硬化是指由於腎動脈及分支和/或小動脈的應化而影響腎血管功能的一類疾病。根據病情進展的快 慢分為良性小動脈性腎硬化和惡性小動脈性腎硬化。 病症原因1....
腎動脈硬化是指由於腎動脈及分支和/或小動脈的應化而影響腎血管功能的一類疾病。根據病情進展的快慢分為良性小動脈性腎硬化和惡性小動脈性腎硬化。...
腎動脈粥樣硬化症,是全身動脈粥樣硬化的一部分,但亦與全身性動脈粥樣硬化的嚴重程度未必平行,臨床多見於60歲以上的老年人,一般無明顯臨床症狀,除了一些病人有微量...
腎動脈粥樣硬化性狹窄(ARAS)是缺血性腎病的主要原因,約占所有腎血管疾病的60%~90%。腎動脈硬化性狹窄主要侵犯腎動脈開口處或近端1~2cm處,有不同程度的動脈...
但近年來伴隨人口老齡化及人們生活方式的變化,糖尿病腎病、高血壓腎小動脈硬化....升高,偶爾也可以不高,但最典型也是最危險的腎臟損害是病人突然出現急進型惡性高...
二、小動脈硬化三、小動脈內膜蔥皮狀增厚四、小動脈纖維素樣壞死...(三)惡性高血壓病(realignanthypertensionandmalignanlnephrosclerosis)...
CKD的病因主要有原發性腎小球腎炎、高血壓腎小動脈硬化、糖尿病腎病、繼發性腎小球腎炎、腎小管間質病變(慢性腎盂腎炎、慢性尿酸性腎病、梗阻性腎病、藥物性腎病等...
高血壓腎病英文:hypertensive renal disease系原發性高血壓引起的良性小動脈腎硬化(又稱高血壓腎小動脈硬化)和惡性小動脈腎硬化,並伴有相應臨床表現的疾病。...
6.腫瘤繼發澱粉樣變 不少惡性腫瘤均可繼發腎澱粉樣變,特別是腎細胞癌霍奇金病...急性腎小球腎炎早期,降低見於慢性腎小球腎炎、高血壓腎小動脈硬化和慢性腎功能...
高血壓腎病(hypertensive renal disease),系原發性高血壓引起的良性小動脈腎硬化(又稱高血壓腎小動脈硬化)和惡性小動脈腎硬化,並伴有相應臨床表現的疾病。...
疾病概述系原發性高血壓引起的良性小動脈腎硬化和惡性小動脈腎硬化,並伴有相應臨床表現的疾病。 疾病症狀早期僅有夜尿增多,繼之出現 蛋白尿 ,個別病例可因毛細...
主要病因有原發性腎小球腎炎、慢性腎盂腎炎、高血壓腎小動脈硬化、糖尿病腎病、...(4)腎微血管疾病 原發性或繼發性壞死性血管炎、惡性高血壓腎損害。 (5)急性...
大動脈閉塞,引起走路時的 間歇性跛行;腎動脈和腎小球動脈硬化、狹窄,導致腎小球萎縮、腎功能損害,繼而引起腎性高血壓,而高血壓又加重血管硬化和腎損害,形成惡性...
安卡性腎炎主要就是由ANCA相關性血管炎引起的腎臟疾病,相關表現為低熱、乏力、...因為惡性高血壓病時的小動脈硬化壞死是全身性的,故常見視網膜小動脈高度縮窄,...
經治療不能恢復者,如慢性腎小球腎炎、慢性腎盂腎炎、雙側腎結核、腎小動脈硬化...二十三、各種惡性腫瘤經過治療不見好轉者。二十四、其他各類腫瘤,嚴重影響肌體...
高血壓性腎損害是指由原發性高血壓所導致的腎臟小動脈或腎實質損害。絕大多數臨床所見的高血壓腎損害是以良性小動脈性腎硬化為主,其發生與高血壓的嚴重程度和...
乾燥綜合徵、系統性血管炎、痛風性腎病、糖尿病腎病、高血壓腎小動脈硬化、良惡性高血壓等)、急性和慢性腎功能衰竭、各種腎小管-間質疾病、泌尿系統感染、腎結石...
